
题目列表(包括答案和解析)
11.下列事实能说明醋酸是弱电解质的是
①醋酸与水能以任意比互溶;②醋酸溶液能导电;③醋酸稀溶液中存在醋酸分子;④常温下,0.1 mol/L醋酸的pH比0.1 mol/L盐酸的pH大;⑤醋酸能和碳酸钙反应放出CO2;⑥0.1 mol/L醋酸钠溶液pH=8.9;⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢⑧pH=a的溶液的物质的量浓度等于pH=a+1的溶液的物质的量浓度的10倍
A.②⑥⑦⑧ B.③④⑥⑦ C.③④⑥⑧ D.①②
10.关于C2H2(g) + 5/2O2(g) = 2CO2(g) + H2O(l) △H =-1300 kJ/mol的说法正确的是
A.10×6.02×1023电子转移时,该反应吸收1300 kJ的热量
B.1mol水的生成且为液体时,该反应放出1300 kJ的热量
C.有2×6.02×1023个碳氧共用电子对的生成,该反应放出1300 kJ的热量
D.有8×6.02×1023个碳氧共用电子对的生成,该反应放出1300 kJ的热量
9.从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡:HIn(溶液,红色)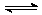 H+(溶液,无色)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为
H+(溶液,无色)+In-(溶液,黄色) 而用作酸碱指示剂。往该溶液中加入Na2O2粉末,则溶液颜色为
A.红色变深 B.黄色变浅 C.黄色变深 D.褪为无色
8.某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸 B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
7.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目
6.有一处于平衡状态的反应:X(s)+3Y(g)  2Z(g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
2Z(g),ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥
5.下列有关工业生产的主要设备中采取的措施不能达到相应目的的是
|
选项 |
化学工业 |
主要设备 |
措施 |
目的 |
|
A. |
电解食盐水 |
电解槽 |
阳离子交换膜 |
只允许阳离子通过 |
|
B. |
合成氨 |
合成塔 |
500℃左右 |
提高氨的日产量 |
|
C. |
接触法制硫酸 |
接触室 |
加入催化剂 |
提高二氧化硫的转化率 |
|
D. |
石油炼制 |
分馏塔 |
减压 |
降低馏分的沸点 |
4.现有反应:CO(g)+H2O(g)
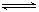 CO2(g)+H2(g),已知1
mol CO和2 mol H2O(g)在一定条件下反应达平衡时生成0.7 mol
CO2,若其它条件不变,把2 mol H2O(g)改成4
mol,达平衡时生成CO2可能是:
CO2(g)+H2(g),已知1
mol CO和2 mol H2O(g)在一定条件下反应达平衡时生成0.7 mol
CO2,若其它条件不变,把2 mol H2O(g)改成4
mol,达平衡时生成CO2可能是:
A.1.2 mol B.0.83 mol C.1.5 mol D.2 mol
3.在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)  4C(g)
+5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是
4C(g)
+5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是
A.0.45 mol / (L·s) B.0.15 mol / (L·s) C.0.225 mol / (L·s) D.0.9 mol / (L·s)
2.能增加反应物分子中活化分子的百分数的是:
A.降低温度 B.使用催化剂 C.增大压强 D.增加浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com