
题目列表(包括答案和解析)
21.(12分)甲烷蒸气转化反应为:CH4(g)+H2O(g) CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。已知温度、压强和水碳比[
CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。已知温度、压强和水碳比[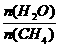 ]对甲烷蒸气转化反应的影响如下图:
]对甲烷蒸气转化反应的影响如下图:
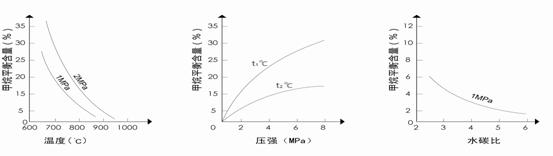
图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
⑴该反应平衡常数K表达式为________________________。
⑵升高温度,平衡常数K__________(选填“增大”、“减小”或“不变”,下同),降低反应的水碳比,平衡常数K__________。
⑶图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);在图3中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
(4)工业生产中使用镍作催化剂。但要求原料中含硫量小于5×10-7%,其目的是___________
20.(6分)为了研究浓度、温度对化学反应速率的影响,利用Na2S2O3(3%)在酸性条件下产生不溶于水的S,形成乳白色浑浊的反应,测量所需时间来证明不同浓度或不同温度下化学反应速率的不同。
(1)写出该反应的离子方程式 。
(2)取3个小烧杯,编号为1、2、3,在烧杯底部中央画上粗细相同的“+”号,按下表分别进行处理,记下从澄清到看不到“+”号所需的时间。
|
编号 |
加Na2S2O3 的体积(mL) |
加水的体积(mL) |
加H2SO4 的体积(mL) |
所需时间(秒) |
|
1 |
5 |
5 |
2 |
a |
|
2 |
7 |
3 |
2 |
b |
|
3 |
10 |
0 |
2 |
c |
① 加水的作用是 。
② a、b、c三者的关系为 。
19.(14分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10.00mL待测液,用 量取。
(4)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,选用酚酞为指示剂,滴定时 手旋转 式滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,直到滴入一滴标准盐酸时溶液立即由 色变成 色, 且半分钟内不褪色,则达到滴定终点。
(5)根据下列数据,计算待测烧碱溶液的物质的量浓度(写出计算过程)。
|
滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
18.已知某弱酸的酸式盐有NaH2XO4和Na2HXO4两种,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,浓度均为0.1mol•L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系是
A.c(H+)•c(OH-)>1×10-14
B.c(H+) + 2c(H3XO4)+ c(H2XO4-)=c(XO43-)+ c(OH-)
C.c(Na+)+ c(H+)= c(H2XO4-)+ c(OH-)+ 2c(HXO42-)+ 3c(XO43-)
D.c(H+) + c(H3XO4)= c(HXO42-)+ 2c(XO43-)+ c(OH-)
17.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
16.某体积可变的密闭容器中盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B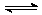 2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是
2C,若维持温度和压强不变,当达到平衡时,容器的体积为VL,其中C气体的体积占10%,下列推断正确的是
A.原混合气体的体积分数为1.2VL B.原混合气体的体积为1.1VL
C.反应达到平衡时,气体A消耗0.05VL D.反应达到平衡时,气体B消耗掉0.05VL
15.用来表示可逆反应2A(g)+B(g)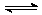 2C(g);△H < 0的正确的图象为
2C(g);△H < 0的正确的图象为
14.某溶液中存在的离子有:S2-、HS-、OH-、Na+、H+:则下列对该溶液的有关叙述中正确的是
A.离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
B.组成该溶液的溶质只能是Na2S或NaHS或两者的混合物
C该溶液可能呈中性,或碱性,或酸性
D.离子物质的量的关系一定是2n(S2-)+n(HS-)+n(OH-)=n(Na+)+n(H+)
13.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是
A.形成产物C和D的化学键所放出的总能量高于
断开反应物A和B化学键所吸收的总能量
B.该反应只有在加热条件下才能进行
C.反应物的总能量高于产物的总能量
D.该反应为吸热反应
12.有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)
溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
下列有关叙述中,正确的是
A.金属锂作电池的负极,石墨作电池的正极
B.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
C.电解质溶液中混入水,对电池反应无影响

 D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com