
题目列表(包括答案和解析)
5. 在2A+B 3C+4D反应中,表示该反应速率最快的是 ( )
在2A+B 3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5mol/L· s B.v(B)=0.3mol/L· s
C.v(C)=0.8mol/L· s D.v(D)=1mol/L· s
4.实验室配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是 ( )
A.防止硫酸铁分解 B.抑制硫酸铁水解 C.提高溶液的PH D.提高硫酸铁的溶解度
3.在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,则所需NaOH溶液的体积( )
A.小于20mL B.大于20mL C.等于20mL D.等于5mL
2. 在HNO2溶液中存在如下平衡:HNO2 H++NO2-
,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是 ( )
在HNO2溶液中存在如下平衡:HNO2 H++NO2-
,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是 ( )
A.NaOH溶液 B.硫酸溶液 C.NaNO2溶液 D.NaHSO4溶液
1.下列条件一定能使反应速率加快的是:①增加反应物的物质的量②升高温度③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2 ( )
A.全部 B.①②⑤ C.② D.②③
26.(11分)将0.3 mol NaCl固体与0.1 mol CuSO4•5H2O固体混合溶于水,配成1000ml混合液。然后取出200ml溶液,用石墨作电极,通电一段时间(不考虑水解)。试回答:
(1)电解过程分为 个阶段,其中第二阶段发生的电解反应的离子方程式为
。
(2)长时间电解后,阳极上发生的电极反应式变为 。
(3)若Cl-正好全部变为氯气逸出时,阴极上产生气体的体积为多少(标准状况下)?
(4)若Cl-正好全部变为氯气逸出时,所得溶液的pH为多少(假设溶液体积不变)?
25.(9分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图
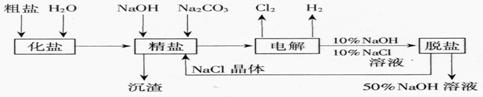
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 (选填a,b,c多选扣分)。 a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂 b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 。
24.(13分)某同学利用如图所示的装置进行中和热测定的实验,实验步骤如下:
①在大烧杯底部垫碎泡沫塑料,放入小烧杯,
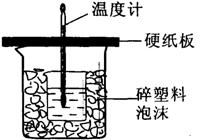 再在大、小烧杯之间填上碎纸条,
再在大、小烧杯之间填上碎纸条,
大烧杯上用硬纸板作盖板
②用一个量筒取50mL2.0 mol·L-1盐酸,
倒入小烧杯中,并用温度计测量盐酸的温度,
然后把温度计上的酸用水冲洗干净
③用另一个量筒取50mL2.0 mol·L-1NaOH溶液,
并用温度计测量NaOH溶液的温度
④把套有盖板的温度计放入小烧杯的盐酸中,并将量筒中的NaOH溶液缓缓倒入小烧
杯中(注意不要洒在外面),盖好盖板。用温度计轻轻搅动溶液(注意不要碰到烧杯底部或烧杯壁),并准确读取混合溶液的最高温度,记为终止温度
⑤________________________________________________________________________
⑥根据实验数据计算中和热
回答下列问题:
(1)请将上面第⑤步的实验步骤补充完整
(2)从实验装置上看,图中尚缺少的一种玻璃仪器是(量筒除外)__________________
(3)为保证该实验成功采取了许多措施,其中最主要的作用在于____________________
(4)在以上①--④步操作或装置图中,有许多不当之处,请一一指出(可不填满,也可补充)
I ______________________________________________________________________
II______________________________________________________________________
III_____________________________________________________________________
IV______________________________________________________________________
V______________________________________________________________________
VI_____________________________________________________________________
(5) 用正确的方法测得含有11.2克KOH的稀溶液与1L0.1 mol·L-1的H2SO4溶液反应,
放出11.46KJ热量,该反应的中和热化学方程式是
___________________________________________________________
23.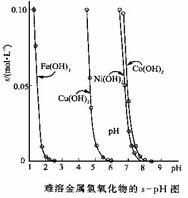 (12分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
(12分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
(1)pH=3时溶液中铜元素的主要存在形式是:____________(写化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为_____
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,_____(能、不能)通过调节溶液pH的方法来除去,理由是________________________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式____________________________________。
(5)已知一些难溶物的溶度积常数如下表。
|
物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_____除去它们。(选填序号)A.NaOH B.FeS C.Na2S
22.(10分)化学兴趣小组通过分析工业合成氨的化学反应:N2(g)+3H2(g) 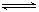 2NH3(g),现在四种实验条件下NH3的浓度(mol/L)随反应时间(min)变化的实验数据如下表,实验条件是:压强恒定(4.31×1010 Pa),N2、H2起始浓度均为0,而温度、浓度等其他条件有所不同。
2NH3(g),现在四种实验条件下NH3的浓度(mol/L)随反应时间(min)变化的实验数据如下表,实验条件是:压强恒定(4.31×1010 Pa),N2、H2起始浓度均为0,而温度、浓度等其他条件有所不同。
|
实验序号 |
 时间(min) 时间(min)
|
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
t7 |
||
|
1 |
500℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
||
|
2 |
500℃ |
1.0 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
||
|
3 |
500℃ |
c |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
||
|
4 |
T |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)可推测实验室2中还隐含的条件是 。
(2)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填<、=、>),且c 1.0 mol/L(填<、=、>)。
(3)比较实验4和实验1,可推测温度T 500℃(填<、=、>)
(4)从影响反应速率和平衡的因素分析,要有利于NH3的生成,在实际合成氨的过程中,要不断分离出NH3,目的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com