
题目列表(包括答案和解析)
24. (12分)“氢能”将是未来最理想的新能源。
(1)实验测得,1克氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为 :
A.2H2(g) + O2(g) = 2H2O(l); △H = -142.9 kJ·mol-1
B.H2(g) + 1/2O2(g) = H2O(l); △H = -285.8 kJ·mol-1
C.2H2(g) + O2(g) = 2H2O(l); △H = -571.6kJ·mol-1
D.H2(g) + 1/2O2(g) = H2O(g); △H = -285.8kJ·mol-1
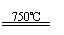
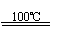 (2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列反应步骤:
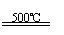
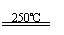 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点是 。
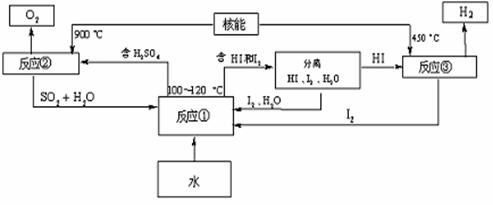 (3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘,。
请写出反应①的化学方程式: ;
用此法制取氢气最大的优点是: ;
(4)有人认为目前利用氢气作为能源不太现实。请问你认为是否现实? (填“不现实”或“现实”),说明能够支持你的观点的两点理由: ;
。
23. (8分) ①CaCO3(s) == CaO + CO2(g);ΔH= 177.7kJ/mol
②C(s) + H2O(g)== CO(g) + H2(g);ΔH= -131.3kJ/mol
③0.5H2SO4(l) + NaOH(l) == 0.5Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) == CO2(g);ΔH= -393.5kJ/mol
⑤CO(g) + 1/2 O2(g) == CO2(g);ΔH= -283kJ/mol
⑥HNO3 (aq) + NaOH(aq) == NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦CH4(g)+4NO2(g)=4NO(g)+C02(g)+2H20(g) △H=-574 kJ·mol-1
(1)上述热化学方程式中,不正确的有___________
(2)根据上述信息,写出C转化为CO的热化学方程式_______________________。
(3)上述反应中,表示燃烧热的热化学方程式有_________;表示中和热的热化学方程式有______________。
22、(8分)有机化学中取代反应范畴很广,下列6个反应中属于取代反应范畴的是(填写相应的字母) 。


 A、 + HNO3
A、 + HNO3 +
H2O
+
H2O
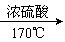
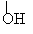 B、CH3CH2CH2CHCH3
CH3CH2CH=CHCH3 + H2O
B、CH3CH2CH2CHCH3
CH3CH2CH=CHCH3 + H2O

C、2CH3CH2OH CH3CH2OCH2CH3 + H2O

D、CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O

E、
 F、(CH3)2CHCH=CH2 + HBr (CH3)2CHCHBrCH3+(CH3)2CHCH2CH2Br
F、(CH3)2CHCH=CH2 + HBr (CH3)2CHCHBrCH3+(CH3)2CHCH2CH2Br
(多) (少)
21、(8分)在下列事实中,什么因素影响了化学反应速率:
(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:_______________________。
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:_______________________。
(3)同浓度、同体积的盐酸中分别放入同样大小的锌粒和镁条,产生气体有
快有慢:_____________________________________。
(4)夏天的食品易霉变,而冬天不易发生该现象:______________________。
20.美国《Science》杂志2006年2月10日报道了“关于植物是怎样互相窃听从而发现附近是否有一个很饿的食草动物”,提出了关于植物能释放出化学“云”(挥发性有机物)的假设。下图就是一种化学“云”--茉莉酮酸酯的结构简式,有关该物质的说法错误的是
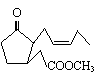 A、该物质不能使酸性高锰酸钾溶液褪色
A、该物质不能使酸性高锰酸钾溶液褪色
B、该物质的分子式为C13H20O3
C、该物质能发生银镜反应
D、该物质在酸性条件下水解程度比碱性条件水解程度小
第II卷 (非选择题 共80分)
19.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
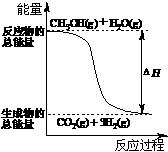 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H= +
49.0 kJ·mol-1
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H= +
49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是
A、CH3OH的燃烧热为192.9 kJ·mol-1
B、反应①中的能量变化如右图所示
C、CH3OH转变成H2的过程一定要吸收能量
D、根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
18. 由乙炔,苯和甲醛组成的混和物中,测得含碳元素的质量百分含量为72%,则混和物中氧元素的质量百分含量为 ( )
A.20.7% B.22% C.24.9% D.28%
17. 已知:C(s)+O2(g)==CO2(g);△H=-393.5 kJ/mol,
2H2(g)+O2(g)==2H2O(g);△H=-483.6 kJ/mol,
现有0.2 mol的炭粉和氢气组成的悬浮气,此混合物在氧气中完全燃烧,共放 出63.53 kJ热量,则混合物中C与H2的物质的量之比为
A.1:1 B 1:2 C.2:3 D.3:2
16.下列情况下,反应速率相同的是
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
15. 设NA为阿伏加德罗常数的数值,则下列说法不正确的是( )
A.73gHCl气体中所含离子总数为4NA
B.1.7gOH-中所含电子数目为NA
C.49g硫酸中所含氧原子数为2NA
D.18gH2O中所含的原子数为3NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com