
题目列表(包括答案和解析)
6.在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3mol/L B.Y2为0.4mol/L C.X2为0.2mol/L D. Z为0.4mol/L
5.在2A+B 3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是( )
3C+4D的反应中,下列用不同物质的变化表示该反应的速率最快的是( )
A.vA=0.5mol·L-1·min-1 B.vB=0.3mol·L-1·min-1
C.vC=0.8mol·L-1·min-1 D.vD=1mol·L-1·min-1
4. 可逆反应A(g)+2B(g)
可逆反应A(g)+2B(g)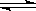 C(g)
在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是
C(g)
在相同压强时,混和气体中A的百分含量跟反应时间t、温度T的关系如图所示,下列结论正确是
A.T1>T2,正反应是放热反应
B.T1>T2,正反应是吸热反应
C.T2>T1,正反应是放热反应
D.T2>T1,正反应是吸热反应
3.能使碳酸钙的分解速率显著增大的措施是
A.增加少量的碳酸钙固体 B.升高温度
C.加入MnO2 D.增大压强
2.下列说法正确的是
A.反应物分子的每次碰撞都能发生化学反应
B.活化分子之间的碰撞一定是有效碰撞
C.能够发生化学反应的碰撞是有效碰撞
D.增大反应物浓度时,活化分子百分数增大
1.能源可划分为一级能源和二级能源,自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由在自然界中大量存在的水来制取: ,该反应需要吸收大量的热,下列叙述正确的是
,该反应需要吸收大量的热,下列叙述正确的是
A.水煤气是二级能源 B.水力是二级能源
C.天然气是二级能源 D. 电能是一级能源
28.(18分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。

图1 图2
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3 的方框中画出上述反应的速率与时间的关系曲线。

图3
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:____________________________________________
____________________________________________________________________。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:_______________________________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中___________________________________,实验b中____
___________________________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
27. (10分)实验室用50 mL0.50 mol/L盐酸、50 mL0.55 mol/LNaOH溶液和下图所示装置 进行测定中和热的实验,得到表中的数据:
|
实验次数 |
起始温度t1/℃ |
 终止温度 终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
试回答下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_______________________,
不能用铜丝搅拌棒代替环形玻璃棒的理由是__________________________。
(2)经数据处理,t2-t1=3.4 ℃。则该实验测得的中和热ΔH = ___________[盐酸和NaOH溶液的密度按1 g/cm3计算,反应后混合溶液的比热容(c)按4.18 J/(g•℃)计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1_______ΔH(填“<”、“>”或“=”),理由是_____ _________。
26.(6分)在2L密闭容器中放入a mol A﹑b mol B,在一定条件下发生如下反应:
2A(g) + B(g) 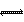 3C(g)若经过t分钟反应达平衡状态,测得前t分钟C物质的生成速度为W mol/(L﹒min),则A物质的转化率为 ,B物质的平衡浓度为
.
3C(g)若经过t分钟反应达平衡状态,测得前t分钟C物质的生成速度为W mol/(L﹒min),则A物质的转化率为 ,B物质的平衡浓度为
.
25. (10分)由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)聚合物F的结构简式是_____________________________________。
(2)D的结构简式是___________________________________________。
(3)B转化为C的化学方程式是__________________________________________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_________________________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为_____________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com