
题目列表(包括答案和解析)
16、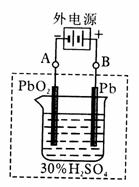 (10分)铅蓄电池是典型的可充型电池,它的正负极
(10分)铅蓄电池是典型的可充型电池,它的正负极 格板是惰性材料,电池总反应式为:
格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是 ;电解液中H2SO4的浓度将变________。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________ (选填: 对换、不变 ).
15、(6分)某同学用0.1×10×25mm、质量分数≥99.5%的铝片和酸反应制取H2,实验现象如下表:
|
时间 酸 |
1min |
2 min |
5 min |
15 min |
20 min |
|
3mol·L-1HCl |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol·L-1H2SO4 |
均无明显现象(无气泡) |
①写出上述铝与酸反应的离子方程式 。
②反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
③为探究铝与盐酸反应比铝与硫酸反应快的原因,有同学猜测是由于SO42-离子对Al和H+的反应起阻碍作用,请你设计一个实验证明这种猜想是否正确,写出操作过程、现象和结论
。
14、用来表示可逆反应:2A(g)+B(g)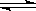 2C(g) △H<0,的正确图象是下图中的
2C(g) △H<0,的正确图象是下图中的
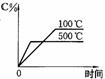
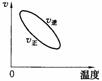
A B C D
江苏省扬中高级中学2008---2009学年度第一学期第二次月考高二化学化学答题纸
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
|
|
|
|
|
|
|
|
|
|
|

第Ⅱ卷(非选择题,共72分)
13、一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol
Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol
Z,下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,X与Y 的浓度相等
12、 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
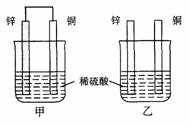
A. 两烧杯中铜片表面均无气泡产生 B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大 D. 产生气泡的速度甲比乙慢
11、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,
可向盐酸中加入适量的
A、NaOH固体 B、K2SO4溶液 C、CuSO4固体 D、CH3COONa固体
10、反应:NO+CO2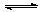 N02+CO在密闭容器中进行,下列哪些条件加快该反应速率
N02+CO在密闭容器中进行,下列哪些条件加快该反应速率
A、缩小体积使压强增大 B、体积不变充入CO2使压强增大
C、体积不变充入He气使压强增大 D、压强不变充入N2使体积增大
9、可逆反应2NO2 2NO+O2,在恒容密闭容器中反应,达到平衡状态的标志是
2NO+O2,在恒容密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥ 混合气体的平均相对分子质量不再改变的状态
A、①④⑥ B、②③⑤ C、①③④ D、①②③④⑤⑥
8.一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应为C2H6 + 18OH-→2CO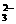 + 12H2O + 14e-;14H2O + 7O2 + 28e-→28 OH-,有关推断错误的是
+ 12H2O + 14e-;14H2O + 7O2 + 28e-→28 OH-,有关推断错误的是
A.通氧气的电极为正极
B.通C2H6的电极为正极
C.放电一段时间后,KOH的物质的量浓度将下降
D.参加反应的氧气和乙烷的物质的量之比为7:2
7.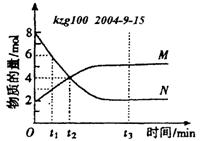 在一定温度下,容器内某-反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
在一定温度下,容器内某-反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com