
题目列表(包括答案和解析)
19.(4分)(1)主要用到沸点、熔点。在850℃时,NaCl、KCl和Na均为熔融态,只有K为蒸气(2)利用平衡移动原理。由于钾蒸气的逸出使化学平衡向正反应方向移动,从而使反应变为现实,制得了金属钾
18、(14分) (1)< 变小 (2)增大 不变 变小 (3)A (4)0.02mol
17.(12分)(1)固体反应物的表面积 表面积越大 1和2
(2)1、3、4、6、8 或 2、5
(3)反应温度 6和7 或 8和9
16、(10分)(1)PbO2 + 2e- + 4H+ +SO42- = PbSO4 + 2H2O 小 (2)Pb; PbO2 ;对换
15、(6分) 17(1)2Al+6H+=2Al3++3H2↑(2分)
(2)该反应是放热反应,温度升高,化学反应速率加快(2分)
(3)在一支试管中加入少量一定浓度的盐酸,加入一小片除去氧化膜的铝片,发现反应较快,然后向其中加入少量的Na2SO4固体,如果反应速率明显变慢,说明SO42-对铝和H+的反应起阻碍作用。(2分)
21、(14分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5mol A、0.5mol B和3mol C,将两容器的温度恒定在770K,使反应3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=_________;若平衡时,甲、乙两容器中A的物质的量不相等,则x=_________。
(2)平衡时甲、乙两容器中A、B的物质的量之比是否相等____________(填“相等”或“不相等”),
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为___________ ,平衡时甲中A的体积分数为____________。
1---14:A/C/B/A/B /A/D/B/ A/AB/BD/C/A/AC
20.(12分)某化学反应2A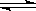 B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是 。
19.(4分)工业上生产Na、Ca、Mg等金属都用电解其熔融状态的氯化物,但制钾却不用电解熔融状态的KC1的方法制得,因为金属钾溶于熔融态的KC1中,很难得到钾。现在生产钾是用金属钠和熔化的KC1反应制取,有关数据如下:
|
|
熔点/℃ |
沸点/℃ |
密度(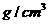 ) ) |
|
Na |
97.8 |
883 |
0.970 |
|
K |
63.7 |
774 |
0.860 |
|
NaCl |
801 |
1412 |
2.165 |
|
KCl |
770 |
1500(升华) |
1.984 |
工业生产金属钾的反应式和条件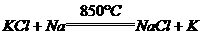 。
。
(1)工业上制金属钾主要运用上表所列的哪些物理常数?
_________________________________________________________________________。
(2)工业上制金属钾主要应用什么原理使反应变为现实?
_________________________________________________________________________。
18、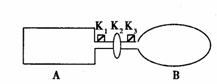 (14分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2
(14分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率αA将_________ (填增大或减小、不变);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将_________,B中NO2的转化率将_________(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A中充人4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为_________
17.(12分)下表是稀硫酸与某金属反应的实验数据:
|
实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,_________ 对反应速率有影响,_________ , 反应速率越快,能表明同一规律的实验还有_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有_________(填实验序号,任填一组即可);
(3)本实验中影响反应速率的其他因素还有_________ ,其实验序号是_______(任填一组即可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com