
题目列表(包括答案和解析)
4.下列关于氨气的说法正确的是( )
A.氨气的检验方法为:将沾有浓盐酸的玻璃棒或者用沾有湿润的蓝色石蕊试纸玻璃棒靠近容器口
B.氨水能导电,所以NH3是电解质
C.制取氨气可以使用NH4Cl受热分解
D.用向下排空气法收集NH3
3.下列关于氮族元素的说法中不正确的是( )
A.原子的最外层均有5个电子,最高价均为+5价
B.非金属性比同周期的氧族元素和卤族元素弱
C.原子半径比同周期的氧族元素、卤族元素小
D.稳定性:NH3 > PH3
2.下列说法正确的是( )
A.电闪雷鸣的雨天,空气中会产生少量NH3
B.磷的非金属性比氮弱,自然界均有游离态氮和磷
C.氮气、磷酸都是制造化肥的原料
D.安全火柴头上的物质一般是红磷和Sb2S3等易燃物
1.将空气中氮气转化为氮的化合物的过程称为固氮。下面能实现人工固氮的是( )
A.闪电 B. NH3催化氧化生成NO C.根瘤 D.合成氨车间
24.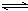 对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,请计算:(1)
x的值是多少?(2) L的转化率是多少?(3) M的反应速率v(M)是是多少?(必须用三段式书写)
对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,请计算:(1)
x的值是多少?(2) L的转化率是多少?(3) M的反应速率v(M)是是多少?(必须用三段式书写)
23.(8分)化学兴趣小组通过分析工业合成氨的化学反应:N2(g)+3H2(g) 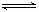 2NH3(g),现在四种实验条件下NH3的浓度(mol/L)随反应时间(min)变化的实验数据如下表,实验条件是:压强恒定(4.31×1010 Pa),N2、H2起始浓度均为0,而温度、浓度等其他条件有所不同。
2NH3(g),现在四种实验条件下NH3的浓度(mol/L)随反应时间(min)变化的实验数据如下表,实验条件是:压强恒定(4.31×1010 Pa),N2、H2起始浓度均为0,而温度、浓度等其他条件有所不同。
|
实验序号 |
 时间(min) 时间(min)
|
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
t7 |
||
|
1 |
500℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
||
|
2 |
500℃ |
1.0 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
||
|
3 |
500℃ |
c |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
||
|
4 |
T |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)可推测实验室2中还隐含的条件是 。
(2)设实验3的反应速率为y3,实验1的反应速率为y1,则y3 y1(填<、=、>),且c
1.0 mol/L(填<、=、>)。
(3)比较实验4和实验1,可推测温度T 500℃(填<、=、>)
(4)从影响反应速率和平衡的因素分析,要有利于NH3的生成,在实际合成氨的过程中,要不断分离出NH3,目的是 。
22.(6分)为了研究浓度、温度对化学反应速率的影响,利用Na2S2O3(3%)在酸性条件下产生不溶于水的S,形成乳白色浑浊的反应,测量所需时间来证明不同浓度或不同温度下化学反应速率的不同。
(1)写出该反应的离子方程式 。
(2)取3个小烧杯,编号为1、2、3,在烧杯底部中央画上粗细相同的“+”号,按下表分别进行处理,记下从澄清到看不到“+”号所需的时间。
|
编号 |
加Na2S2O3 的体积(mL) |
加水的体积(mL) |
加H2SO4 的体积(mL) |
所需时间(秒) |
|
1 |
5 |
5 |
2 |
a |
|
2 |
7 |
3 |
2 |
b |
|
3 |
10 |
0 |
2 |
c |
① 加水的作用是 。
② a、b、c三者的关系为 。
21.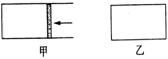 (10分)一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol/L。经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)。
(10分)一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol/L。经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)。
(1)容器中气体出现红棕色的原因是(用化学方程式表示) ;
(2)前2s内,乙容器中以N2O4的浓度变化表示的平均反应速率为 ;
(3)达到平衡时,甲容器中反应所需的时间 60 s (填“大于”、“小于”或“等于”,以下同);两容器中都达到平衡时,N2O4的浓度:甲 乙。
(4)两容器都达到平衡后,若要使甲、乙中N2O4浓度相等,不能采取的措施是 。
A.保持温度不变,适当压缩甲容器 B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
20.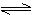 (6分)某温度下,在某固定体积的密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),SO2和O2的起始浓度分别为3mol/L和2 mol/L,达平衡时,80%的SO2转化为SO3,这时c(SO2)=
,c(O2)=
,c(SO3)=
。容器内压强等于反应前压强的 %。如果温度不变,向上述平衡体系中通入氩气,容器内压强将
(从“增大”、“减小”、“不变”中选填),平衡 移动(从“正向”、“逆向”、“不”中选填)。
(6分)某温度下,在某固定体积的密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),SO2和O2的起始浓度分别为3mol/L和2 mol/L,达平衡时,80%的SO2转化为SO3,这时c(SO2)=
,c(O2)=
,c(SO3)=
。容器内压强等于反应前压强的 %。如果温度不变,向上述平衡体系中通入氩气,容器内压强将
(从“增大”、“减小”、“不变”中选填),平衡 移动(从“正向”、“逆向”、“不”中选填)。
19.(4分) 有下列离子:K+、Mg2+、Ba2+、Cu2+、Na+、CO2-3 、SO2-4 、OH-、 NO-3、Cl-等按其在溶液中大量共存的原则,将上述离子等分成二组(要求每组不少于两种阳离子和两种阴离子),则两组分别是甲OH-_______________________ 乙 _________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com