
题目列表(包括答案和解析)
2.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.钢铁发生吸氧腐蚀时正极反应式:Fe -2e- == Fe2+
1.2008年北京奥运会的国家游泳中心(水立方)采用ETFE(乙烯-四氟乙烯共聚物)作为屋顶材料。下列对ETFE及其单体的说法错误的是
A.ETFE是一种高分子材料
B.ETFE的单体中所有原子均共面
C.ETFE的单体通过加聚反应合成ETFE
D.ETFE的链节一定为“-CH2-CH2-CF2-CF2-”
0.05mol的气体时,CuSO4恰好被完全电解,得密度为1.2g/cm3的溶液200mL,求:
(1)电解后所得溶液的pH.
(2)电解前所取CuSO4溶液的质量.
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入一种什么物质,质量为多少克?

 高二化学第一学期期中考试(实验班)
高二化学第一学期期中考试(实验班)
21、(10分)某温度下,取一定质量的硫酸铜溶液,用石墨作电极进行电解,当阳极产生
20.(10分)1 mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1 molB和1 molC。B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中C原子数相同,且Mr(B)=Mr(C)+2。
⑴ C的分子式为 ,A的摩尔质量为 ;
⑵ B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式 ;
⑶ C有多种同分异构体,其中属于酯类的同分异构体有 种;
⑷ C分子中苯环上有两个取代基,且苯环上的一氯取代物有两种。写出A的结构简式 。
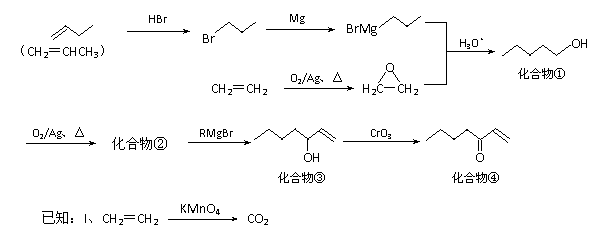
19.(12分)以乙烯、丙烯为初始原料合成抗高血压药物维普罗斯托(Viprostol)中间体化合物④的合成线路如下:
II、氧化性:K2Cr2O7>KMnO4>CrO3
请回答下列问题:
⑴ 反应①中原子利用率为 ;
⑵ 写出化合物②的键线式: ;
⑶ 卤代烃和Mg在无水乙醚中生成的化合物RMgX被称为格林试剂,格林试剂在有机合成中具有广泛运用。反应③的格林试剂RMgBr中,R-的结构简式为 ;
⑷ 上述合成线路中,与反应④的反应类型相同的反应还有 ;反应④中使用CrO3而不使用K2Cr2O7,可能的原因是 ;
⑸ 化合物①-④中,含有手性碳原子的是 。
18.(10分)高温下,炼铁高炉中存在下列平衡:
FeO(s)+CO(g)  Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。
回答下列问题:
⑴ 写出该反应的平衡常数表达式: 。
⑵ 升高温度,该反应的平衡常数K值将 (“增大”、“减小”或“不变”,下同),平衡体系中固体的质量将 。
⑶ 已知1100℃时该反应的平衡常数K=0.263。在1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L。此时该的化学反应速度是v(正) v(逆)(“大于”、“小于”或“等于”),原因是 。
⑷ 保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值
(“大于”、“小于”或“等于”)0.263。
17.(8分)有机物分子中官能团之间相互影响,使得有机物分子中某些原子或原子团的活
性发生变化而更易发生某些化学反应。请回答下列问题:
⑴ 苯、苯酚与Br2反应的产物分别为一元取代物和三元取代物,说明羟基的存在使苯酚中苯环上的 ;
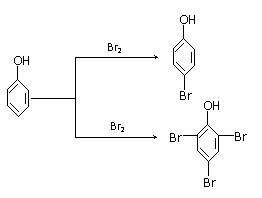 ⑵ 事实证明,苯酚的卤代反应与反应环境有关,在酸性环境中生成一元取代物,在碱性环境中生成三元取代物(如下)。可能的原因是
;
⑵ 事实证明,苯酚的卤代反应与反应环境有关,在酸性环境中生成一元取代物,在碱性环境中生成三元取代物(如下)。可能的原因是
;
⑶ 写出苯酚在酸性条件下分别与下列物质发生卤代反应的化学方程式:
① 次氯酸 ;
② (CH3)3COCl 。
16.(10分)由化学能产生的能量是目前人类使用的主要能源。回答下列问题:
⑴ N2和O2在一定条件下反应生成NO2的热化学方程式为:
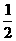 N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
⑵ 化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
|
化学键 |
键能(kJ/mol) |
化学键 |
键能(kJ/mol) |
|
N≡N |
942 |
H-O |
460 |
|
N-H |
391 |
O=O |
499 |
|
H-H |
437 |
|
|
① 写出N2和H2反应合成氨的热化学方程式 。
② 已知:1molH2O(g)转化为1molH2O(l)时放出44.0 kJ的热量。计算1g H2完全燃烧时放出的热量
。H2O(g)的稳定性 (“大于”、“小于”)H2O(l)。
⑶ 写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式 。
15.(12分)乙酸乙酯是重要的有机合成中间体,广泛应用于
化学工业。为证明浓硫酸在实验室制备乙酸乙酯反应中起
催化剂和吸水剂的作用,某同学利用右图所示装置进行了
以下四个实验,实验开始先用酒精灯微热3min,再加热使
之微微沸腾3min。实验结束后充分振荡试管2,再测有机
层的厚度,实验记录如下:
|
实验 编号 |
试管1中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
|
A |
2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 |
饱和碳酸钠 溶液 |
5.0 |
|
B |
3mL乙醇、2mL乙酸 |
0.1 |
|
|
C |
3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 |
1.2 |
|
|
D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |
(1) 如果用CH3COOH和C2H518OH进行反应制备乙酸乙酯,写出反应的化学方程式:
________ ____________________。
(2)干燥管在上述实验中的作用_________ ________________________。
(3) 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol/L。
(4)分析实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 。
(5)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低, 可能的原因是 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com