
题目列表(包括答案和解析)
1.在学习“化学反应的速率和化学平衡”一章后,四位同学联系工业生产实际所发表的下列观点,你认为不正确的是: A.化学反应速率理论是研究怎样在一定时间内快出产品 B.化学平衡理论是研究怎样使用有限原料多出产品 C.化学反应速率理论是研究怎样提高原料转化率 D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
21.(11分)将含有C.H、O的有机物4.88 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了12.32g。已知该有机物的相对分子质量为122。
⑴燃烧此有机物4.88g,须消耗氧气的质量是多少?
⑵通过计算确定该有机物的分子式?
⑶如果该有机物1个分子中存在1个苯环和1个侧链,试写出它的所有同分异构体的结构简式。

 江苏省扬中高级中学2008- -2009学年度第一学期高二期中考试(普通班)
江苏省扬中高级中学2008- -2009学年度第一学期高二期中考试(普通班)
20.(10分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
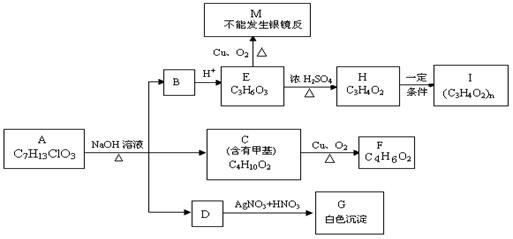
(1)A的结构简式: ;
(2)写出反应类型: E→H 、H→I ;
(3)写出C→F的化学方程式: 。
(4)请设计出由丙烯合成CH3-CH(OH)-COOH的反应流程图(有机物用结构简式表示,必须注明反应条件)。


 提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:
B C …… G
19、(10分)有机物X( )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多。
(1)有机物中含有的官能团名称是 ;在一定条件下有机物X可发生化学反应的类型有 (填序号);
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应
(2)下列物质与X互为同分异构体的是 (填序号);
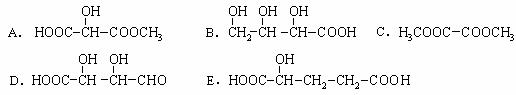
(3)写出X与金属钠发生反应的化学方程式: ;
(4)写出X与氧气在铜作催化剂加热的条件下发生反应所得的可能产物的结构简式 。
18.(10分)(1)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。氢-氧燃料电池有酸式和碱式两种,它们放电时的电池总反应为: 2H2 + O2 = 2 H2O 。酸式氢-氧燃料电池的电解质是酸,其负极反应可表示为: 2H2 – 4e- = 4 H+,其正极反应表示为___________ ;碱式氢-氧燃料电池中的电解质是碱,其正极反应表示为: O2 +2H2O+4e-=4OH-,则其负极反应可表示为:
(2)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,正极板上覆盖PbO2,
负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42-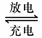 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是__________________________
充电时:阴极的电极反应式是
(3)现代工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请
回答下列问题:
①该过程总的离子反应方程式为:
电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使
用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸, 其合理的加入顺序为
_________________(填试剂序号)。
②离子交换膜的作用是 。
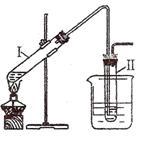
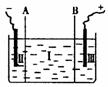 ③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的功能--只允许阳
离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它只
允许阴离子通过,可阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4
溶液,通电电解。阴极的电极反应式为_____________________________,
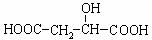
17.(10分)有机合成的思路就是通过有机反应构建目标化合物的分子骨架,并引入或转化所需的官能团。请各用一个有机化学方程式表示在有机物中引入相应官能团的方法(请注明反应条件,且:如果反应类型相同,则要求反应物含有不同的官能团;如果反应物含有相同的官能团,则要求反应类型不相同)。
⑴在有机物中引入官能团
反应① ;反应② ;反应③ 。
⑵在有机物中引入官能团“-X”:
反应① ;反应② ;反应③ 。
⑶在有机物中引入官能团“-OH”:
反应① ;反应② ;反应③ ;反应④ 。
16.(10分)由化学能产生的能量是目前人类使用的主要能源。回答下列问题:
⑴ N2和O2在一定条件下反应生成NO2的热化学方程式为:
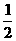 N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
⑵ 化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
|
化学键 |
键能(kJ/mol) |
化学键 |
键能(kJ/mol) |
|
N≡N |
942 |
H-O |
460 |
|
N-H |
391 |
O=O |
499 |
|
H-H |
437 |
|
|
① 写出N2和H2反应合成氨的热化学方程式 。
② 已知:1molH2O(g)转化为1molH2O(l)时放出44.0 kJ的热量。计算1g H2完全燃烧时放出的热量 。H2O(g)的稳定性 (“大于”、“小于”)H2O(l)。
⑶ 写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式 。
15.(11分)实验室用右图所示的装置制取溴乙烷。在试管I中依次
加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠
粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管
I至微沸状态数分钟后,冷却。
试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 (任写两种结构简式)。
(3)设计实验证明试管Ⅱ收集的溴乙烷中含有溴元素,完成以下实验报告:
|
实验步骤 |
实验操作 |
现象及结论 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
(4)请写出(3)中涉及的所有方程式。
14..能够使反应Cu+2H2O==Cu(OH)2+H2 发生的是
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
 非
选 择 题(共72分)
非
选 择 题(共72分)
13..X、Y两种有机物的分子式不同,但均含有C、H或C、H、O,将X、Y以任意比例混合,只要物质的量之和不变,完全燃烧时的耗氧量和生成水的物质的量也分别不变.则下列有关判断正确的是
A.X、Y分子式中氢原子数一定要相同,与碳原子数的多少无关
B.若X为CH4,则相对分子质量最小的Y是甲醇
C.若X为CH4,则相对分子质量最小的Y是乙二醇
D.X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com