
题目列表(包括答案和解析)
26.有66.4g KClO3和MnO2的混合物,加热一段时间后,质量变为56.8g,将此剩余固体平均分成两份。
(1)一份加入足量的水后,过滤,在滤液中加入足量的硝酸酸化的AgNO3溶液,可得沉淀多少克?
(2)一份加入足量的浓盐酸,加热使之反应,将放出的氯气通入到含有KI、KBr的1L混合溶液,恰好使溶液中的Br-、I-完全反应。若c(KI)=c(KBr)=0.4mol·L-1,试求KClO3的分解率。(已知氯酸钾与浓盐酸的反应方程式为KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O)
25.实验室常用澄清石灰水检验CO2。已知t℃时,Ca(OH)2的溶解度是0.185 g。试计算:
(1)在t℃时,向盛有500 g水的烧杯中加入7.77 g Ca(OH)2粉末,充分搅拌。求制得的石灰水中OH-离子的物质的量浓度。(假设溶液体积仍为500 mL,下同)
(2)若采用向⑴的烧杯中通入二氧化碳气体的方法,使烧杯的溶液中Ca2+离子的浓度降低至0.010 mol·L-1,则需要向烧杯中至少通入标准状况下二氧化碳多少升?
24.某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答:
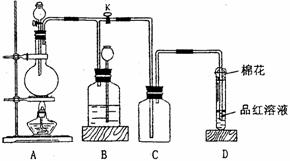
(1)装置A中发生的化学反应方程式为_____________________________________。
(2)装置D中试管口放置的棉花中应用一种液体浸湿,这种液体是_____________,其作用是吸收多余SO2,防止污染空气。
(3)当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,B装置作用是_____________,B中应放置的液体是(填字母)______________。
A.水 B.酸性KMnO4 溶液
C.溴水 D.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。有一定量的余酸但未能使铜片完全溶解,你认为原因是______________________。
23.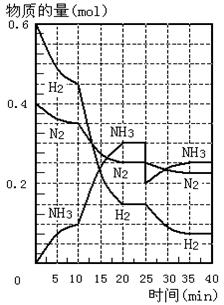 在一定条件下,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如右图:
在一定条件下,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如右图:
(1)计算反应开始10分钟内,NH3的平均反应速率__________________。
(2)反应处于平衡状态的时间是:__________
(3)图中10-20分钟曲线发生变化的可能原因是_________________________________。
(4)第25分钟,平衡改变的条件是________________________,此时正反应速率__________________(填增大、减小或不变),重新达平衡后,NH3的体积分数比原平衡__________________(填大、小或不变)。
22.A+、B+两种阳离子,其核外电子总数相同,现将含A+的盐与含B+的碱共热,可以生成一种能使湿润的红色石蕊试纸变蓝色的气体,则A+的电子式为:___________;含B+的碱的电子式为:___________;该反应的离子方程式为:______________________
21.下列反应的离子方程式正确的是:
A.向次氯酸钠溶液中通入过量CO2:ClO-+CO2+H2O→HClO+HCO3-
B.碳酸钠溶液与醋酸溶液混合:CO32-+2HAc→2Ac-+H2O+CO2↑
C.碳酸氢铵溶液与足量烧碱溶液反应:HCO3-+OH-→CO32-+H2O
D.次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+H2O+SO2→CaSO3↓+2HClO
20.鉴别NO2和Br2蒸气,下列实验不可行的是:
A.溶于水 B.通入AgNO3溶液中
C.通入氢氧化钠溶液 D.用湿润的淀粉碘化钾试纸
19.将H2S通入到下列物质中,不会产生浑浊或沉淀的是:
A.硫酸亚铁溶液 B.亚硫酸 C.溴水 D.氢氧化钠溶液
18.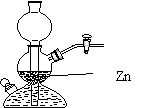 用右图所示的启普发生器制取氢气时,欲使得到氢气的速率加快,下列措施可行的是:
用右图所示的启普发生器制取氢气时,欲使得到氢气的速率加快,下列措施可行的是:
A.将锌粒换成锌粉
B.将稀硫酸换成浓硫酸
C.给装置反应部分加热
D.向稀硫酸中加入少量硫酸铜
17.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是:
A.60 mL B.45 mL C.30 mL D.15 mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com