
题目列表(包括答案和解析)
22.(4分)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5KJ热量,其热化学方程式为 ,又已知:H2O(l) = H2O(g);△H =+44KJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 KJ。
21.(6分)化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4与H2C2O4反应中,可通过观察单位时间内_______________变化来测定该反应的速率;在Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O反应中,该反应的速率可通过____________________________来测定。
20.经一定时间后,可逆反应aA+bB cC中物质的含量A%和C%随温度的变化曲线如右图所示,下列说法正确的是 ( )
cC中物质的含量A%和C%随温度的变化曲线如右图所示,下列说法正确的是 ( )
 A.该反应在T1、T3温度时达到化学平衡
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
第二卷 (非选择题 共60分)
19.镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:
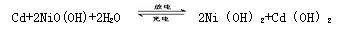
(以强碱为电解质)以下说法中正确的是 ( )
A.以上反应是可逆反应 B.放电时,镉为正极
C.充电时电解质溶液的PH值不变
D.以镍镉电池为电源电解Na2SO4水溶液,当收集到气体的总体积为33.6L(标况下)时,电池中转移了2mol电子。
18. 在容积不变的密闭容器中进行如下反应:H2O(g)+C(s) H2(g)+CO(g) △H>0,达到平衡后,改变下列反应条件,相关叙述正确的是
( )
H2(g)+CO(g) △H>0,达到平衡后,改变下列反应条件,相关叙述正确的是
( )
A.加入H2O(g),平衡向正反应方向移动,体系压强减小
B.加入少量C,正反应速率增大
C.降低温度,平衡向正反应方向移动 D.加入CO,混合气体的密度增大
17.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8 kJ·mol-1、1411.0kJ·mol-1和1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为 ( )
A.-44.2 kJ·mol-1 B.+44.2kJ·mol-1
C.-330kJ·mol-1 D.+330kJ·mol-1
16.一定条件下硝酸受热分解的未配平化学方程式为:NH4NO3→HNO3+N2+H2O,在反应中被氧化与被还原的氮原子个数比为 ( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
15. 在一个密闭容器中发生如下反应:2SO2 (g)+O2(g) 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是
( )
在一个密闭容器中发生如下反应:2SO2 (g)+O2(g) 2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能出现的数据是
( )
A.C(SO3)=0.4mol·L-1 B.C(SO3)+C(SO2)=0.15 mol·L-1
C.C(O2)=0.3mol·L-1 D.C(SO3)+C(SO2)=0.4 mol·L-1
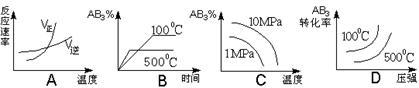
14.对于可逆反应2AB3(g)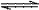 2A(g) + 3B2(g) ΔH>0 下列图象不正确的是
( )
2A(g) + 3B2(g) ΔH>0 下列图象不正确的是
( )
13.在一密闭溶器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)  2C(g) ,反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
( )
2C(g) ,反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
( )
A.40% B. 50% C.60% D.70%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com