
题目列表(包括答案和解析)
6.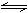 向甲乙两个容积均为1L的恒容容器中分别充入2molA、2molB和1molA、1molB。在相同条件下,发生反应:A(g)+B(g) xC(g);△H<0。测得两容器中C(A)随时间t的变化如图所示,则下列说法中正确的是
( )
向甲乙两个容积均为1L的恒容容器中分别充入2molA、2molB和1molA、1molB。在相同条件下,发生反应:A(g)+B(g) xC(g);△H<0。测得两容器中C(A)随时间t的变化如图所示,则下列说法中正确的是
( )
 A.达到平衡时,容器甲中气体的密度是容器乙中气体密度的2倍。
A.达到平衡时,容器甲中气体的密度是容器乙中气体密度的2倍。
B.若将乙容器单独升温可以使乙容器内各物质的体积分数与甲容器内的相同。
C.保持温度不变,再向容器甲中充入2molA、2molB,达到新平衡时,甲容器中
C(A)为1.56mol/L。
D.x可能等于2也可能等于3。
5.在一密闭容器中,反应aA(g) 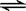 bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的60%,则
( )
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的60%,则
( )
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.化学计量数关系:a>b
4.有合成氨3H2+N2 2NH3 现有A、B、C、D四只容器中,每个容器中有两种操作,两种操作分别达到平衡后,N2和NH3转化率之和不为1的是(起始体积相同)
( )
2NH3 现有A、B、C、D四只容器中,每个容器中有两种操作,两种操作分别达到平衡后,N2和NH3转化率之和不为1的是(起始体积相同)
( )
A.恒温恒容:操作一:加1mol N2和3mol H2; 操作二:加2molNH3
B.恒温恒压:操作一:加1mol N2和3mol H2; 操作二:加2molNH3和1molHe
C.恒温恒容:操作一:加1mol N2和3mol H2; 操作二:加3molNH3
D.恒温恒压:操作一:加1mol N2和3mol H2; 操作二:加3molNH3
3.化学反应N2+3H2=2NH3的能量变化如图所示,下列说法正确的是 ( )
A.该反应的热化学方程式是 1/2N2(g)+3/2H2(g)=NH3(g);△H =-(a+b)kJ·mol-1
B.该反应的热化学方程式 N2(g)+3H2(g)=2NH3(g); △H =-2bkJ·mol-1

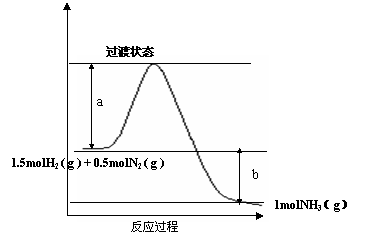 C.当使用催化剂时,a值变小,b值不变
C.当使用催化剂时,a值变小,b值不变
D.当使用催化剂时,a值变小,b值变小
|
2.有一种便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力。A极通入空气,B极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-,下列对该燃料电池的说法不正确的是 ( )
A.在熔融电解质中,O2-由负极移向正极 B.电子从A极移向B极
C.电路中每流过10 mol电子,标准状况下约有11.2 L丙烷被完全氧化
D.通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-===3CO2+4H2O
1.某反应:A=== B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是( )
A.△H<0、△S<0 B.△H>0、△S<0
C.△H<0、△S>0 D.△H>0、△S>0
26.(20分)氨是重要的氮肥,合成原理为:N2(g)+3H2(g)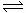 2NH3(g);△H= -92.4 kJ/mol。回答下列问题:
2NH3(g);△H= -92.4 kJ/mol。回答下列问题:
(I)写出平衡常数K表达式 ,如果降低温度,该反应K值 ,化学反应速率 ,N2 的转化率 (填“增大”、“减小”或“不变”);
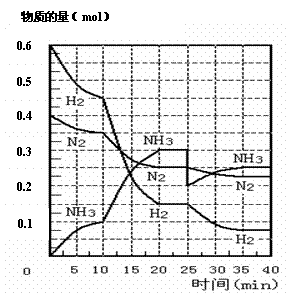 (II)在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如右下图,回答下列问题:
(II)在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如右下图,回答下列问题:
(1)10 min内以NH3表示的平均反应速率:
;
(2)在10 ~20 min内:NH3浓度变化的原因可能是
;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间为: ,
第2次平衡的时间为: ,
第1次平衡:平衡常数K1 =
(带数据的表达式),
第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:① 曲线发生变化的原因
,
② 达第二次平衡时,新平衡的平衡常数K2 K1(填“大于”、“等于”、“小于”);
(5)在25-40 min时,计算合成氨过程中的反应热△H= 。
(实验班必做题,共50分)
25.(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)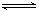 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n1(N2)=13 mol,n1(NH3)=6 mol,则a的值为 ;
(2)反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。平衡时NH3的物质的量为 ;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)。n1(始)∶n1(平)= ;
(4)原始混合气体中,a∶b= ;
(5) 达到平衡时,N2和H2的转化率之比,n1(N2)∶n1(H2)= ;
(6)平衡混合气体中,n1(N2)∶n1(H2)∶n1(NH3)= 。
24.(6分)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g。请回答以下问题:
(1)锌片上发生的电极反应: ,
银片上发生的电极反应: ;
(2)产生氢气的体积(标准状况)为 ;
(3)转移的电子的物质的量为 。
23.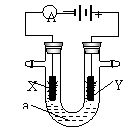 (12分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;
(12分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;
X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴
酚酞试液,则:
①电解池中X极上的电极反应式为 ,
在X极附近观察到的实验现象是 ;
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜(含锌、铁、银),电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 ;
②Y电极的材料是 ,电极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com