
题目列表(包括答案和解析)
21.(8分)将2.1g镁-铝合金投入到60mL 4mol•L-1的盐酸
中,充分反应后金属完全溶解,再向反应后的溶液中逐滴
加入2 mol·L-1的NaOH溶液,生成沉淀的质量与所加氢
氧化钠溶液的体积关系如右图,回答下列问题。
(1)0→a段及b→c段所对应的溶液中发生反应的离子方程为:
0→a: ;b→c:
(2)b点时所加NaOH溶液的体积为 mL,所得沉淀质量为 g。
19.(7分)已知X是一种碱式盐,H是常见的轻金属单质,F、I是常见的非金属单质,D为一种淡黄色固体化合物,它们有下图所示关系:
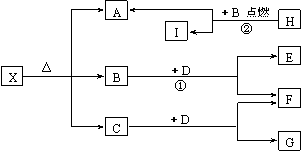
试回答下列问题:
(1)G的电子式为 。
(2)写出上列框图中反应①和②的化学方程式:① ;② 。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸中HCl的物质量之比为3∶8,则X的化学式为 。X与盐酸反应的化学方程式为: 。
18.(10分)实验室用下图所示的实验装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置中的硬质玻璃管中的固体物质是FeO和Fe2O3的混合物。
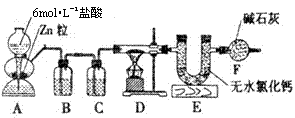
(1)写出D装置中发生反应的化学方程式 。
(2)装置B的作用是 ,装置C中装的液体试剂是 。
(3)若FeO和Fe2O3固体混合物的质量为23.2g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为 g。
(4)U型管E右边又连接干燥管F的目的是 ,若无干燥管F,则测得Fe2O3的质量将 (填:“偏大”、“偏小”或“无影响”,下同)。
(5)若反应后得到的残留固体中还有少量FeO,则测得Fe2O3的质量将
17.(6分)利用下列实验用品:
①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗
Na2CO3固体;标准NaOH溶液;未知浓度盐酸; NaCO3溶液。
进行下列实验或操作:
(1)做酸碱中和滴定时,还缺少的试剂是:
(2)配制250mL 0.1mol•L-1某溶液时,还缺少的仪器是:
(3)过滤时,应选用上述仪器中的 (填编号)
16.将某弱酸HA a mol与其盐NaA b mol溶于水配成混合溶液,已知该混合溶液中c(H+)+c(HA)=c(Na+)+c(OH-),则对该溶液的分析错误的是( )
A.若c(H+)>c(OH-),则c(A-)>c(HA) B.若c(H+)<c(OH-),则c(HA)>c(A-)
C.a=b D.a>b
第Ⅱ卷(非选择题,共60分)
15.现有①0.1mol•L-1醋酸溶液、②0.1mol•L-1盐酸、③pH=1的醋酸溶液,分别加水稀释,使体积变为原来的10倍,对于稀释前后溶液的有关说法错误的是( )
A.稀释前,溶液pH:①>②=③
B.稀释后,溶液pH:①>②=③
C.稀释前,溶液中溶质的物质的量浓度:③>①=②
D.稀释后,溶液中溶质的物质的量浓度:③>①=②
14.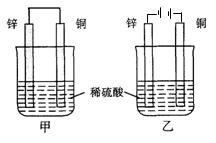 将纯锌片和纯铜片按右图所示方式插入同浓度的稀H2SO4中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按右图所示方式插入同浓度的稀H2SO4中一段时间,以下叙述正确的是( )
A.两烧杯中铜片均有气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液pH均增大
D.甲中的锌比乙中的锌腐蚀慢
13.已知H2A为二元酸,其酸式盐NaHA的水溶液呈碱性,则下列有关结论错误的是( )
A.H2A为二元弱酸
B.NaHA水溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
C.物质的量浓度相同时,碱性:Na2A>NaHA
D.H2A在水溶液中电离方程式为:H2A=2H++A2-
12.某烧杯中盛有含0.1mol (NH4)Al(SO4)2的溶液,现向其中缓缓加入2mol•L-1 NaOH溶液150mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
A.Al3+和Al(OH)3 B.Al(OH)3
C.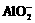 和Al(OH)3 D.
和Al(OH)3 D.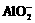
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com