
题目列表(包括答案和解析)
32.(本题共10分)A、B、C、D是四种短周期元素,其中A、B、C为同一周期的相邻的三种元素,A、C的原子序数之比为3:4。A、B、C都可与D形成电子总数相同的化合物。
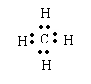 (1)A、B、C与D形成的电子总数相同的化合物的化学式分别为 CH4 、NH3 、 H2O ;
(1)A、B、C与D形成的电子总数相同的化合物的化学式分别为 CH4 、NH3 、 H2O ;
其中,分子结构呈正四面体的化合物的电子式为 。
(2)写出这四种元素组成的既能与盐酸反应又能与氢氧化钠溶液反应的常见物质的化学式 NH4HCO3或(NH4)2CO3。(只写一种)
(3)B、C、D按原子个数比2:3:4形成的化合物的水溶液显 酸 性,理由是
NH4++H2O NH3·H2O+H+ (用离子方程式表示)。
NH3·H2O+H+ (用离子方程式表示)。
31.(本题共6分)化学反应2A+B=2C达到化学平衡时,根据以下条件各选择正确的选项填空。
(1)升高温度时,C的量增加,此反应 ② 。
① 是放热反应;②是吸热反应;③没有显著的热量变化;④原化学平衡没有发生移动。
(2)如果A、B、C都是气体,达到平衡时减小压强,那么 ③ 。
①平衡不移动;②平衡向正反应移动;③平衡向逆反应移动;④C的浓度会增大。
(3)如果已知B是气体,增大压强时,化学平衡向逆反应方向移动,那么 ④ 。
①A是气体、C是固体;②A、B、C都是气体;③A、C都是固体;④A是固体、C是气体。
30.(本题共6分)某无色混合气体可能含有CO2、CO、NH3、N2、HCl、H2中的一种或几种,依次进行以下处理(假设每次处理均反应完全):①通过浓硫酸时,气体体积缩小;②通过碱石灰时,气体体积缩小;③通过炽热的氧化铜时,固体变为红色;④通过白色硫酸铜粉末时,粉末变为蓝色;⑤通过澄清石灰水时,溶液变浑浊。由此可以确定原混合气体中:一定含有__CO2、CO、NH3、H2____;可能含有___ N2__;一定不含__HCl___(填化学式)。
29.(本题共4分)汽车行驶时会产生污染大气的尾气CO、NO、NO2 等。现在已发明一种装有特殊催化剂的装置,使氮氧化物与一氧化碳相互反应,生成无污染的氮气和二氧化碳。试写出NO、NO2 分别与CO反应的化学方程式:
① 2NO+2CO
 N2+2CO2
N2+2CO2
② 2NO2+4CO 
 N2+4CO2
N2+4CO2
28.(本题共4分)下列事实不能用勒夏特列原理解释的有___D___E_______。(多选、错选均不给分)
A.实验室制取氯气时,常用饱和食盐水除去混在氯气中的氯化氢气体
B. 2SO2+O2 2SO3反应中,常鼓入过量的空气提高SO2的转化率
2SO3反应中,常鼓入过量的空气提高SO2的转化率
C.高压有利于合成氨的反应
D.升温至500℃左右,比室温时更有利于合成氨的反应
E.加入催化剂以增大合成氨反应速率
F.减小压强NO2的颜色先变浅后变深
G.可乐饮料瓶打开后会逸出气体
27.(本题共3分)设反应C+CO2 2CO (吸热反应)的反应速率为v1 ,2SO2+O2
2CO (吸热反应)的反应速率为v1 ,2SO2+O2 2SO3
(放热反应)的反应速率为v2 。对于上述反应当反应温度升高时,v1和 v2的变化情况为 均加快 。
2SO3
(放热反应)的反应速率为v2 。对于上述反应当反应温度升高时,v1和 v2的变化情况为 均加快 。
26.(本题共8分)氮族元素位于元素周期表的 第ⅤA 族、共 五 种元素,其元素符号分别为 N、P、As、Sb、Bi ,其中非金属性最强的是 N 。
25.“三聚氰胺”,有一个貌似美妙的别名“蛋白精”,曾在网络广告中频频大摇大摆地出现,公然标榜“能提高产品蛋白含量”。在“结石门”事件中,这个白色的小晶体“大显威风”,击败了众多的“聪明人”。三聚氰胺添加到牛奶中后,在制作的过程中会产生另外一种化学物质---三聚氰酸。三聚氰胺与三聚氰酸结合在一起后形成网络状结晶,可堵塞肾小管,随着结晶在体内含量的增多,如果不能排除,积累到一定的程度后形成结石,给肾功能带来极大的损害。已知三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:C3N3(OH)3 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是 ( )
A.C3N3(OH)3与HNCO为同一物质
B.HNCO是一种很强的氧化剂
C.1 mol NO2在反应中转移的电子为4 mol
D.反应中NO2是还原剂
第Ⅱ卷(非选择题 共75分)
24.亚硫酸是二元中强酸,亚硫酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHSO3溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是 ( )
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(SO32-)+c(HSO3-)
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(SO32-)>c(HSO3-)
23.用过量的铜片分别与含1 mol溶质的浓硫酸.浓硝酸充分反应,被还原的酸的物质的量是 ( )
A.均为1 mol B.前者<1/2 mol,后者在1/4~1/2 mol之间
C.均为1/2 mol D.前者<1/2 mol,后者>1/2 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com