
题目列表(包括答案和解析)
1.燃烧2 g乙醇(液态),生成二氧化碳气体和液态水,经测定放出的热量为Q,则乙醇燃烧的热化学方程式书写正确的是( )
A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -23Q KJ/mol
B.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = - Q /23 KJ / mol
C.1/2 C2H5OH(1)+3/2O2(g)=CO2(g)+3/2H2O(1) △H = -QKJ /mol
D.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = +23Q KJ/mol
0.60mol,其分解率α1等于_________;
若反应温度由T1升高到T2,平衡时
PCl5的分解率为α2,α1_______α2
(填“大于”、“小于”或“等于”)。
(2)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
24.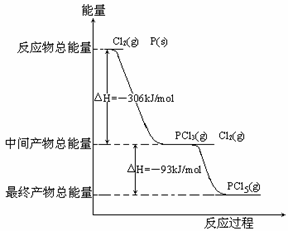 (15分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
(15分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)PCl5分解成PCl3和Cl2的热化学方程
式____________________________,
上述分解反应是一个可逆反应,温度
T1时,在密闭容器中加入0.80molP
Cl5,反应达到平衡时PCl5还剩
23.(11分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),反应过程如下图所示:
CH3OH(g),反应过程如下图所示:
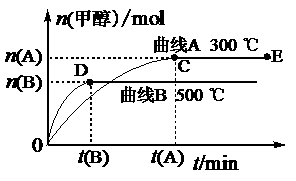
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=
[用n(B)、t(B) 表示]。
(3)在其他条件不变的情况下,对处于E点的体系将体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,若反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_______________________________________(用化学方程式表示)。
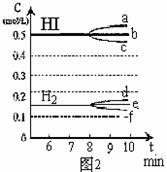
22.(12分)在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应: H2(g)+I2(g)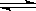 2HI(g) DH<0
2HI(g) DH<0
反应中各物质的浓度随时间变化情况如图1:
(1)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 ;
(2)反应达到平衡后,第8分钟时:
①若升高温度, HI浓度的变化正确的是 ;(用图2中a-c的编号回答)
②若加入适量的I2,H2浓度的变化正确的是 。(用图2中d-f的编号回答)
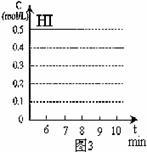
(3)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
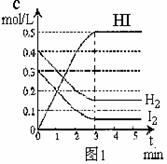
21.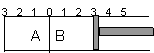 (12分)如图所示,温度不变下某容器分隔成A、B
(12分)如图所示,温度不变下某容器分隔成A、B
两部分,A容器固定不变,B有可移动的活塞,现在
A中充入2molSO2和1molO2,在B中充入2 molSO3
和1molN2,在相同条件下发生可逆反应:
2SO2(g)+O2(g)  2SO3(g),根据下列要求填空:
2SO3(g),根据下列要求填空:
(1)固定活塞位置在3处不动,达到平衡后,设A中压强为P1,B中压强为P2,则P1与P2的压强是P1 P2 (填“<”、“>”、“=”)。
(2)若要使A中与B中平衡状态相同,可移动活塞的位置应在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x y的(填“<”、“>”、“=”),理由是
20.一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是 ( )
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是 ( )



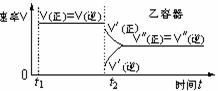
图1 图2 图3
A. 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小
C. 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
第Ⅱ卷 非选择题 (共50分)
19.某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时A、B、C 的物质的量分别为4mol,2mol,4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
2C(g)达到平衡时A、B、C 的物质的量分别为4mol,2mol,4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
A.均增加1mol B.均减半
C.均加倍 D.均减少1mol
18.化学反应N2+3H2 = 2NH3的能量变化下图所示,该反应的热化学方程式是( )
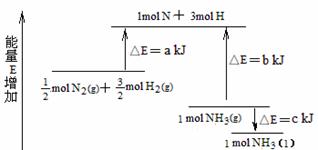
A.N2(g)+3H2(g)  2NH3(l) △H = 2(a-b+c) kJ/mol
2NH3(l) △H = 2(a-b+c) kJ/mol
B.N2(g)+3H2(g)  2NH3(l) △H = 2(a-b-c) kJ/mol
2NH3(l) △H = 2(a-b-c) kJ/mol
C. N2(g)+
N2(g)+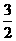 H2(g)
H2(g)  NH3(l) △H = (b+c-a) kJ/mol
NH3(l) △H = (b+c-a) kJ/mol
D.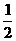 N2(g)+
N2(g)+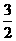 H2(g)
H2(g)  NH3(g) △H = (a+b) kJ/mol
NH3(g) △H = (a+b) kJ/mol
17.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列说法正确的是( )
Si(s)+4HCl(g);△H=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列说法正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com