
题目列表(包括答案和解析)
21.把0.02mol/LHAc溶液和0.01mol/LNaOH溶液以等体积混和后溶液呈酸性,则混合液中微粒浓度关系正确的为 ( )
A.c(Ac-)>c(Na+) B.c(HAc)>c(Ac-)
C.2c(H+)=c(Ac-)-c(HAc) D.c(HAc)+c(Ac-)=0.01mol/L
20.设氨水的pH=x,某盐酸的pH=y,已知x+y=14,且x>11。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) H4+)>c(Cl-)>c(H+)>c(OH-)
H4+)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
19.实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是 ( )
A.c(B+)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
18.将20ml 0.1mol/L的醋酸钠溶液与10ml 0.1mol/L盐酸混合后,溶液显酸性,则溶液中有关粒子的浓度关系正确的是( )
A.c(CH3COO─)> c(Cl─)> c(H+)> c(CH3COOH)
B.c(Cl─) > c(CH3COO─) > (CH3COOH) >c(H+)
C.c(CH3COO─)= c(Cl─)> c(H+)> c(CH3COOH)
D.c(CH3COO─)+ c(Cl─) +c(OH─) = c(H+)+c(Na+)
17.将ag含NaOH样品溶解在bmL 0.l mol·L-1的硫酸中,再加入cmL 0.1mol·L-1的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是( )
A.[(b-c)/125a]×100% B.[(b-2c)/125a]×100%
C.[(b-c)/250a]×100% D.[(8b-8c)/a]×100%
16.实验室用100mL 0.10mol/L盐酸去滴定100mL 0.10mol/L NaOH溶液,如果允许滴定误差为±0.1%,则滴定终点时溶液的pH范围是 ( )
A.5-8 B.3.3-10.7 C.4.3-9.7 D.4.4-10
15.下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
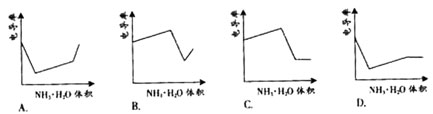
14.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率 变化可以确定滴定反应的终应。右图是KOH溶液分别滴定HCl溶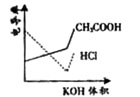 液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表 示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表 示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
13.将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是 ( )
A.c(HCOO-)< c(Na+) B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-) D.c(OH-)> c(HCOO-)
12.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
2SO2 (g) + O2
(g)  2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a
kJ热量,加入各物质的物质的量可以是 ( )
2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a
kJ热量,加入各物质的物质的量可以是 ( )
A.4molSO2和2molO2 B.5molSO2和3molO2
C.4molSO2和4molO2 D.2molSO2、1molO2和2molSO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com