
题目列表(包括答案和解析)
26.(6分) (1) 。
(2) 。
(3)能否改用甲基橙作指示剂? ,若用甲基橙作指示剂,则测定结果如何? 。
25.(7分)(1)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________。
(2)c0= ________________________。
(3)_______________(填是或否)
24.(12分)⑴①______________________________________;
②______________________________________;
③______________________________________。
⑵这些微粒中浓度为0.01mol/L的是________,浓度为0.002mol/L的是_________。
⑶物质的量之和为0.01mol的两种微粒是_________________。
⑷ _________和________两种微粒数量之和比OH-多0.008mol。
28.(7分) 为测定固体烧碱中NaOH的质量分数C%是否在80%±2%的范围内(设烧碱中的杂质不与硫酸反应),取Wg样品配成500mL溶液,取出VmL的烧碱溶液用0.2000mol·L-l H2SO4标准溶液滴定。若要使到达滴定终点时,所滴入的0.2000mol·L-1H2SO4溶液的毫升数恰好等于C的,则:
(1)应取多少毫升待测的样品溶液用于滴定?
(2)若希望取用20.00mL待测溶液用于滴定,则所称取的样品的质量W是多少克?
(3)在题设条件下,若测定的固体烧碱的质量分数在80%±2%的范围内,则滴入的标准硫酸溶液的体积[可用V(H2SO4)表示]是多少毫升?
化学科试卷 主观题答题区
27.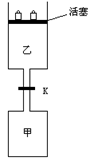 (9分) 如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
(9分) 如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g)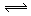 C(g)
C(g) +2D(g);ΔH<0
+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为 (用含V的代数式表示,连通管中气体体积忽略不计。)
26.(6分)用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞用指示剂),试回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3沉淀溶解而能测定NaOH的含量?
。
(2)滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?
。
(3)能否改用甲基橙作指示剂? ,若用甲基橙作指示剂,则测定结果如何? 。
25.(7分)
抗击“非典”期间,过氧乙酸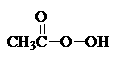 是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① 2MnO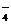 +5H2O2+6H+ = 2Mn2++5O2↑十8H2O
+5H2O2+6H+ = 2Mn2++5O2↑十8H2O
② H2O2+2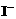 +2H+ = I2 +2H2O
+2H+ = I2 +2H2O
③ 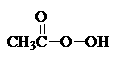 +2
+2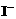 +2H+ = CH3COOH+I2+H2O
+2H+ = CH3COOH+I2+H2O
请回答以下问题:
(1)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(2)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·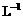 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·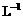 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(3)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
24.(12分)常温下将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液。
⑴用化学用语表示该溶液中的三个平衡关系是:
①______________________________________;
②______________________________________;
③______________________________________。
⑵这些微粒中浓度为0.01mol/L的是________,浓度为0.002mol/L的是_________。
⑶物质的量之和为0.01mol的两种微粒是_________________。
⑷ _________和________两种微粒数量之和比OH-多0.008mol。
23.在pH等于1的酸溶液与pH等于13的NaOH溶液中,分别加入过量的铝粉,若酸溶液放出的氢气多,其可能的原因是 ( )
A.两溶液体积相同,酸是多元强酸
B.酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上
C.两溶液体积相同,酸是弱酸
D.酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上
第Ⅱ卷(非选择题,共41分)
22.常温下,某一元强酸HA和一元弱碱BOH的pH之和为14,有关这两种溶液混合的说法中不正确的是( )
A.混合之前两种溶液中由水电离产生的c(H+)相同
B.若混合后恰好完全中和,反应液中水的电离程度比纯水中大
C.若混合后溶液呈中性(pH=7),V(HA)> V(BOH)
D.若等体积混合两种溶液,反应后因生成强酸弱碱盐而使溶液呈酸性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com