
题目列表(包括答案和解析)
17.(14分)A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A1溶液中的水的电离程度小于A2溶液中水的电离程度;B1溶液中的水的电离程度小于B2溶液中水的电离程度;
(1)请写出化学式:A1___ ____A2___ ____B1____ ___B2__________.
(2)相同条件下,当A1、B1的物质的量浓度相同时,两溶液中水电离出的H+的物质的量浓度之比为________________.
(3)B1溶液中的水的电离程度小于B2溶液中水的电离程度,原因是
___________________________________________________________________.
(4)若B1、B2两溶液PH=5,则两溶液中水电离出的H+的物质的量浓度之比为_________________.
16.(10分)由化学能产生的能量是目前人类使用的主要能源。回答下列问题:
⑴ N2和O2在一定条件下反应生成NO2的热化学方程式为:
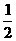 N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
N2(g)+O2(g)=NO2(g) △H=+34kJ/mol。该反应为 (“放热”、“吸热”)反应。
⑵ 化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
|
化学键 |
键能(kJ/mol) |
化学键 |
键能(kJ/mol) |
|
N≡N |
942 |
H-O |
460 |
|
N-H |
391 |
O=O |
499 |
|
H-H |
437 |
|
|
① 写出N2和H2反应合成氨的热化学方程式 。
② 已知:1molH2O(g)转化为1molH2O(l)时放出44.0 kJ的热量。计算1g H2完全燃烧时放出的热量 。H2O(g)的稳定性 (“大于”、“小于”)H2O(l)。
⑶ 写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式 。
15.实验室中常用中和滴定、氧化还原滴定方法测定未知浓度的某反应物的物质的量浓度或测定某样品的纯度。
(1)请回答下列关于指示剂的选用问题
①用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,应选择 作指示剂。滴定操作中,左手应 ,右手应 ,眼睛注视 。
②用已知浓度的硫代酸钠滴定未知浓度的碘水时,应选择 作指示剂。(有关反应的化学方程式2Na2S2O3+I2=Na2S4O6+2NaI)
③用已知浓度的高锰酸钾溶液滴定未知浓度的硫酸亚铁酸性溶液时, 指示剂(填“需要”或“不需要”),滴定终点颜色变化为: 。高锰酸钾溶液应装在 滴定管中(填“酸式”或“碱式|)。
(2)用已知浓度为的盐酸滴定未知浓度稀氢氧化钠溶液时,为减小误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是 (填选项字母)。
A.1mol·L-1、50mL B.0.2 mol·L-1、25mL
C.0.02 mol·L-1、5mL D.5 mol·L-1、5mL
(3)用已知浓度为的盐酸滴定未知浓度稀氢氧化钠溶液时,下列操作对结果是否造成影响? (A、无影响 B、偏高 C、偏低)
装氢氧化钠溶液的锥形瓶没有用氢氧化钠溶液润洗; ( )
将氢氧化钠溶液移入锥形瓶的过程中滴定管没有润洗; ( )
装盐酸的滴定管在滴定前有气泡,滴定后无气泡; ( )
14.常温下,将0.02mol/L的Ba(OH)2溶液100mL和0.02mol/LNaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液
A.pH=12 B.pH=2
C.由水电离的产生的c(H+)=0.01mol/L D.溶质的物质的量浓度=0.02mol/L
第二卷(非选择题 共72分)
13. 我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:LaNi5H6 + 6NiO(OH) LaNi5
+ 6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
我国镍氢电池居世界先进水平,国产大功率镍氢动力电池已广泛用于我海军潜艇。常见镍氢电池的某极是储氢合金LaNi5,电池的总反应为:LaNi5H6 + 6NiO(OH) LaNi5
+ 6Ni(OH)2(LaNi5H6中各元素化合价均为零),下列说法正确的是
A.放电时储氢合金作正极 B.放电时,电子由负极通过外电路流向正极
C.充电时储氢合金作阴极 D.充电时阴极反应:Ni(OH)2 + OH――e-= NiO(OH)+H2O
12.右图表示温度和压强对平衡状态下可逆反应2M(g)+N(g) 2Q(g) △H<0的 影响。下列有关说法正确的是
2Q(g) △H<0的 影响。下列有关说法正确的是
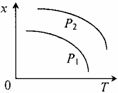 A.x不可能是M或N的体积分数
A.x不可能是M或N的体积分数
B.x可能是混合气体的物质的量
C.该反应在P1时先达到化学平衡状态
D.P1>P2
11.常温下,将a1mol/L、b1mL的CH3COOH溶液和a2mol/L、b2mL的NaOH溶液混合,当a1b1=a2b2时,下列有关叙述正确的是
A.所得溶液的pH=7
B.所得溶液中c(CH3COO-)=c(Na+)-c(CH3COOH)
C.所得溶液中c(Na+)+c(OH-)=c(H+)+c(CH3COO-)
D.所得溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
10.阿佛加德罗常数约为6.02×1023 mol-1下列说法中正确的是
A.25℃时,纯水中含有的H+数为1×10-7×6.02×1023
B.Na与H2O反应生成1.12LH2(标准状况),反应中转移的电子数为0.1×6.02×1023
C.100mL0.2mol/L的Fe2(SO4)3溶液中,含有的Fe3+数为0.1×0.2×6.02×1023
D.46gN2O4气体中所含有的原子数为3×6.02×1023
9.下列能用勒沙特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
8.2005年10月12日我国成功发射了“神州六号”。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g);△H =+67.7kJ/mo
N2H4(g)+O2(g) N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A.2N2H4(g)+2NO2(g)
3N2(g)+4H2O(l);△H=-1135.7kJ/mol
B.2N2H4(g)+2NO2(g)
3N2(g)+4H2O(g);△H=-1000.3kJ/mol
C.N2H4(g)+NO2(g)
3/2N2(g)+2H2O(l);△H=-1135.7kJ/mol
D.2N2H4(g)+2NO2(g)
3N2(g)+4H2O(g);△H=-1135.7kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com