
题目列表(包括答案和解析)
20.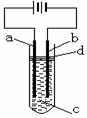 (8分)由于Fe(OH)2极易被氧化,所以实验室里很难用亚铁盐与
(8分)由于Fe(OH)2极易被氧化,所以实验室里很难用亚铁盐与
烧碱反应制得白色纯净的Fe(OH)2沉淀,用如右图所示电解实验
可制得白色纯净的Fe(OH)2沉淀,两电极材料分别为石墨和铁。
(1)a电极材料应为 ,电极的电极反应式为 。
(2)电解液c可以是(填编号) 。
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为 ,在加入苯之前,对c溶液应
做何简单处理? 。
(4)若c中用了Na2SO4溶液,当电解一段时间看到白色的Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中的的另一明显现象为 。
19. (12分)830K时,在密闭容器中中发生下列可逆反应CO+H2O(g) CO2+H2,
(12分)830K时,在密闭容器中中发生下列可逆反应CO+H2O(g) CO2+H2,
△H<0。试回答下列问题:
(1)若起始时c (CO)=2 mol/L,c (H2O)=3 mol/L,达到平衡时CO的转化率为60%,则平衡常数K= ,此时水蒸气的装化率为 。
(2)在相同温度下,若起始时c (CO)=1 mol/L,c (H2O)=2 mol/L,反应进行一段时间后,测得H2的浓度为0.5mol/L,则此时该反应是否达到平衡状态 (填“是”或“否”),此时v正 V逆(填“<”、“>”或“=”)。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 。(填“增大”、“减小”或“不变”)
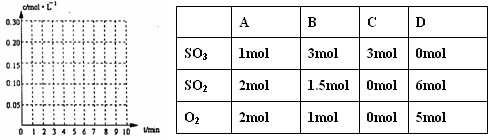
18.(8分)在20L恒容的密闭容器中,加入3mo1SO3 (g) 和l mo1O2,在一定温度下使其反
应,反应至4min时,氧气的浓度为0.09 mol·L-1,当反应到8min时,反应到达平衡,
此时三氧化硫浓度c (SO3) = a mol·L-1。
(1)0min-4min内生成O2平均速率v(O2) = mol·L-1·min-1
(2)达到平衡时c (O2)=c (SO2),则a = mol·L-1,在下列坐标系中作出
0min-8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是
17.(8分)已知1molCO气体完全燃烧生成CO2气体放出283KJ热量;1molH2完全燃烧生成液态水放出286KJ热量;1mol CH4气体完全燃烧生成CO2气体和液态水放出890KJ热量。
(1)写出氢气完全燃烧的热化学方程式: 。
(2)若1mol CH4气体完全燃烧生成CO2气体和水蒸气,放出热量 890KJ(填“>”“=”或“<”=。
(3)若将a mol CH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,则放出的热量(Q)的取值范围是 。
(4)若将a mol CH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的取值范围是 。
16. (10分)50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH
(10分)50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH
溶液在右图所示的装置中进行中和反应。通过测定反应过程中所
放出的热量可计算中和热。请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 ;
由图可知该装置有不妥之处,应如何改正? 。
(2)烧杯间填满碎塑料泡沫的作用是 。
(3)大烧杯上如不盖硬纸板,则求得的中和热数值 (填
“偏大”、“偏小’、“无影响”)。
(4) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),理由是 ;若实验操作均正确,所求中和热的数值会 (填“相等”或“不相等”),
(5)己知在稀溶液中,强酸与强碱发生中和反应生成1 mol水时,放出57.3kJ的热量,写出该反应的热化学方程式: 。
15.下列说法正确的是 ( )
A.PH=2与PH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
C.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
D.0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1
第Ⅱ卷(55分)
14.下列有关金属腐蚀与防护的说法正确的是 ( )
A.纯银器表面在空气中会渐渐变暗是因发生了电化学腐蚀
B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
13.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
该电池负极发生的反应是 ( )
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
12.已知25℃时,BaSO4的饱和溶液中存在:BaSO4(s) Ba2+(aq)+SO42-(aq),
Ba2+(aq)+SO42-(aq),
Ksp=1.1025×10-10,下列有关BaSO4的溶度积和溶解平衡的叙述正确的是 ( )
A.25℃时,向c(SO42-)=1.05×10-5mol/L的BaSO4溶液中,加入BaSO4固体,c(SO42-)增大
B.向该饱和溶液种加入Ba(NO3)2固体,则BaSO4的溶度积常数增大
C.向该饱和溶液种加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO42-)
D.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO42-)减小
11.下列关于电解质溶液中离子关系的说法中正确的是 ( )
A.0.1mol/L的NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
B.0.1mol/L NH4Cl和0.1mol/L NH3·H2O等体积混合后离子浓度关系:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.常温下,在PH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存
D.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的PH=7,则混合液中:
c(Na+)=c(CH3COO-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com