
题目列表(包括答案和解析)
15. 下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
14.放热反应CO(g)+H2O(g) 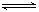 CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0
mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0
mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
13. 用0.1000mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
12. 在一密闭容器中,反应
aA(气) bB(气)达平衡后,保持温度不
在一密闭容器中,反应
aA(气) bB(气)达平衡后,保持温度不
变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%则
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数减小了 D.a>b
11. 在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
10.下列事实中,不能用勒夏特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
C.打开汽水瓶,有气泡从溶液中冒出
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
9.在平衡体系Ca(OH)2(s) 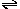 Ca2++2OH
-中,能使c(Ca2+)减小,而使c(OH -)增大的是:
Ca2++2OH
-中,能使c(Ca2+)减小,而使c(OH -)增大的是:
A.加入少量MgCl2固体 B.加入少量Na2CO3固体
C.加入少量KCl固体 D.加入少量Ca(OH)2固体
8.下列各组热化学方程式程中,△H的绝对值前者大于后者的是 ①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2 ②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4 ③H2(g)+1/2O2(g)=H2O(l);△H5 2H2(g)+O2(g)=2H2O(l);△H6 A.① B.② C.② ③ D.①②③
7.在下列实验方法中,不能证明醋酸是弱酸的是
A.25℃时,醋酸钠溶液呈碱性
B.25℃时,0.1 mol/L的醋酸的pH约为3
C.25℃时,等体积的盐酸和醋酸,前者比后者的导电能力强
D.25℃时,将pH=3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水多
6.在一定温度下,将物质的量都为2 mol的A和B充入一密闭容器中,发生如下反应:A(g)+2B(g) 2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为
2C(g)。反应达到平衡时,C的物质的量为1.6 mol,则此时A的转化率为
A.30% B.40% C.50% D.80%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com