
题目列表(包括答案和解析)
25.(10分)一定条件下,在体积为3
L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) 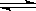 CH3OH(g)
CH3OH(g)
不同温度时甲醇的物质的量随时间变化曲线如上右图所示。根据题意完成下列各题:
⑴ 反应达到平衡时,平衡常数表达式K = ,升高温度,K值 (填“增大”、“减小”或“不变”)。
⑵500℃,从反应开始到平衡,H2的反应速率v(H2)= mol·(L·min)-1
⑶ 在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减小 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
e 平衡常数K增大
⑷ 据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
24.(8分)(1) 家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式________ __ _,已知1mol液态水气化时需要吸收44kJ的热量,则1mol丁烷完全燃烧生成二氧化碳和水蒸汽时的ΔH为_____________。
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ/mol;2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为多少?(请写出解答过程)
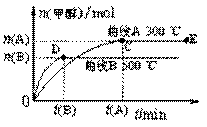
23. (10分)
(10分)
⑴课本设计了如图一所示实验,其目的是通过比较H2O2的分解速率来比较
,可通过观察 来定性比较。有同学提出将CuSO4改为CuCl2更为合理,其理由是 。
⑵已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和
草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久
突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_______
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
22.(12分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
① 将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由__________ _ ________。
 (2)滴定时边滴边摇动锥形瓶,眼睛应观察_____
____
__;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_____
____
__;
(3)该小组在步骤①中的错误是_________,由此造成的测定结果___________ (填偏高、偏低或无影响);
(4)步骤②缺少的操作是_______ __ _ _;
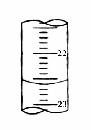
(5)右图,是某次滴定时的滴定管中的液面,其读数为___________mL;
(6)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
25.00 |
0.40 |
20.38 |
|
第二次 |
25.00 |
4.00 |
24.02 |
请计算待测烧碱溶液的物质的量浓度。(请写出解答过程)
21.(10分)(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 。稀释后还需要加入一些铁粉,其目的是 ,相关反应的离子方程式为 。
(2)氯化铁水溶液呈 性 ,原因是(用离子方程式表示):
_____________________ ____ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
20.同温下,有甲、乙两瓶醋酸稀溶液,测得甲pH=a,乙pH=a+l,下列推断正确的是
A.物质的量浓度c(甲)是c(乙)的10倍
B.溶液中的c(OH-)甲是乙的10倍
C.由水电离产生的c(H+)乙是甲的2倍
D.与等量的NaOH反应消耗甲、乙两酸的体积v(乙)>10V(甲)
19.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO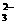 和OH-
和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
18、下列说法或表示正确的是
A.次氯酸的电离方程式:HClO=H++ClO-
B.只有熵增加的过程才能自发进行
C.HS-水解离子方程式:HS-+H2O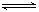 H3O++S2-
H3O++S2-
D.已知中和热为57.3 kJ·mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH (aq)== Na2SO4 (aq)+2H2O ( l ) ΔH=-114.6 kJ·mol-1
17.有关AgCl沉淀的溶解平衡,说法正确的是
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
16.在密闭容器中有反应mA(g)+nB(g) pC(g) (正反应吸热)处于平衡状态,已知m + n > p,则下列说法正确的是
pC(g) (正反应吸热)处于平衡状态,已知m + n > p,则下列说法正确的是
①升温时c(B)/ c(C)比值减小 ②充入C,则A、B的物质的量增大
③充入B,则A的转化率变大④加入催化剂,气体的总物质的量不变
A.①② B.②③ C.③④ D.①②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com