
题目列表(包括答案和解析)
9、下列说法正确的是 ( )
A.增大压强,活化分子百分数增大,化学反应速率一定增大
B.升高温度,活化分子百分数增大,化学反应速率可能增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率
8、强酸和强碱的稀溶液的中和热可表示为: H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H=-Q1kJ/mol
1/2 H2SO4(浓) +NaOH(aq)=1/2Na2SO4(aq) +H2O(1) △H=-Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H=-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为 ( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
7、下列不能用勒夏特列原理解释的是 ( )
A.棕红色的二氧化氮加压后颜色先变深后变浅
B.工业合成氨中把氨液化从混合物中分离出来
C.用排饱和食盐水的方法收集氯气
D.加入催化剂有利于氨的合成
6、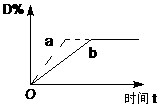 已知反应 3A(g)+B(g)
已知反应 3A(g)+B(g)
 C(s)+4D(g),△H<0,右图中a、b表示在一定条件下,D的体积分数随时间(t)的变化情况。若使曲线b变为曲线a ,可采取的措施是
( )
C(s)+4D(g),△H<0,右图中a、b表示在一定条件下,D的体积分数随时间(t)的变化情况。若使曲线b变为曲线a ,可采取的措施是
( )
A.增大B的浓度 B.升高温度
C.增大反应容器的体积 D.加入催化剂
5、在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:
2A(g) + B(g)  2C(g),达平衡时,在相同条件下测得容器内混合气体的压强是反应前的
2C(g),达平衡时,在相同条件下测得容器内混合气体的压强是反应前的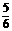 ,则A 的转化率为 ( )
,则A 的转化率为 ( )
A.67% B. 50% C. 25% D. 5%
4、下列说法正确的是( )
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
3、已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v (NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是 ( )
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O)
C.3v(NH3)=2v(H2O) D.4v(O2)=5v(NO)
2、可以证明可逆反应N2 + 3H2 2NH3已达到平衡状态的是:①一个
2NH3已达到平衡状态的是:①一个 断裂的同时,有3个H-H键断裂②一个
断裂的同时,有3个H-H键断裂②一个 键断裂的同时,有6个N-H键断裂③其它条件不变时,混合气体平均相对分子质量不再改变④保持其它条件不变时,体系压强不再改变⑤NH3%、N2%、H2%都不再改变⑥恒温恒容时,密度保持不变⑦正反应速率v(H2)=0.6mol/(L•min),逆反应速率v(NH3)= 0.4mol/(L·min)
( )
键断裂的同时,有6个N-H键断裂③其它条件不变时,混合气体平均相对分子质量不再改变④保持其它条件不变时,体系压强不再改变⑤NH3%、N2%、H2%都不再改变⑥恒温恒容时,密度保持不变⑦正反应速率v(H2)=0.6mol/(L•min),逆反应速率v(NH3)= 0.4mol/(L·min)
( )
A.全部 B.②③④⑤⑥⑦ C.②③④⑤⑦ D.只有③④⑤⑥⑦
1、4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 (X)(反应物的消耗速率或产物的生成速率)可表示为
( )
(X)(反应物的消耗速率或产物的生成速率)可表示为
( )
A. (NH3)= 0.010 mol·L-1·s-1 B.
(NH3)= 0.010 mol·L-1·s-1 B. (O2) = 0.0010 mol·L-1·s-1
(O2) = 0.0010 mol·L-1·s-1
C. (NO) = 0.0010 mol·L-1·s-1 D.
(NO) = 0.0010 mol·L-1·s-1 D. (H2O) = 0.045 mol·L-1·s-1
(H2O) = 0.045 mol·L-1·s-1
26.(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
 H2A =
H+ + HA-
HA-
H+ + A2-
H2A =
H+ + HA-
HA-
H+ + A2-
回答下列问题:
(1)用离子方程式表示Na2A溶液显“酸性”“或中性”或“碱性”的原因
__________________________________________ __
(2)在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A.c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B.c(OH-)=c(H+) +c( HA-)+2c(H2A)
a+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
a+ ) >c(A2-)>c( HA-) >c(OH-) >c(H+)
(3)常温下,已知0.1mol·L-1NaHA溶液的pH=2,则当H2A溶液中c(H+)为0.11 mol·L-1时,H2A溶液的物质的量浓度应___________ 0.1mol/L(填“>”或“<”或“=”); 理由是 。
(4)比较①0.1mol·L-1 Na2A溶液 ②0.1mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小① ②(填“>”或“<”或“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com