
题目列表(包括答案和解析)
1.下列气体中不会造成空气污染的是
A.N2 B.NO C.NO2 D.CO
21(11分)、在合成氨反应中,进入合成塔的气体体积比为N2∶H2∶NH3=6∶18∶1,从合成塔出来的气体体积比为N2∶H2∶NH3=9∶27∶8,求H2的转化率。
2008-2009学年度第1学期
19(3分)、发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。已知:
N2H4 (g) + O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
写出肼和二氧化氮反应的热化学方程式为 ;
20(10分)、在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
(1)平衡时CO的转化率为 ,该反应的化学平衡常数为 。
(2)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
(3)427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
16(8分)、为了测量化学反应速率与浓度之间的关系, 小明以测量锌与硫酸反应放出H2的体积来测定该反应的速率。
(1)请你在氢气的发生装置后画出其中的一种测量方法的装置图。

(2)如果在t 分钟内收集到的H2的体积为v mL,则在t 分钟内以H2表示的反应速率为______________________。
(3)你还能够通过测量哪些相关的量来测定该反应的速率?
17(4分)、下表是研究性学习小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(单位:s)
 浓 度 浓 度反应条件 |
30% H2O2 |
15% H2O2 |
10% H2O2 |
5% H2O2 |
|
无催化剂、不加热 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
几乎不反应 |
|
无催化剂、加 热 |
360 |
480 |
540 |
720 |
|
MnO2催化剂、加热 |
10 |
25 |
60 |
120 |
请你分析回答:
(1)该研究小组在设计方案时,考虑了浓度、 、 等反应条件对过氧化氢分解速率的影响。
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
18(14分)、工业生产硝酸的流程图如下

请回答下列问题:
(1)写出硝酸在工农业生产中的重要作用_______________________(任写一条)。
 (2)已知N2(g) +3H2(g)
(2)已知N2(g) +3H2(g)  2NH3(g) ;
2NH3(g) ;
ΔH=-92.4kJ·mol-1。请回答:
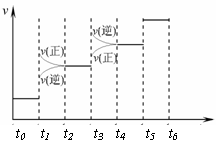
① 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是 。其中表示平衡混合物中NH3的含量最高的一段时间是 。
②温度为T ℃时,将2a mol H2和a mol N2放入
0.5L密闭容器中,充分反应后测得N2的转化率为50﹪。则该反应的化学平衡常数的数值为 。
(3)氨催化氧化的化学方程式为_________________________,该反应是放热反应,当温度升高时,反应的化学平衡常数K值____(增大、减小、无影响)。
(4)今年“两会”后,党和国家更加重视环保。工业上常用纯碱溶液来吸收硝酸厂尾气中的二氧化氮,吸收产物中有亚硝酸钠、硝酸钠和二氧化碳,该化学方程式为__________;还可以利用氢气在催化剂下把氮的氧化物还原为_____ 和水。
15、已知某可逆反应mA(g)+nB(g) pC(g)在密闭容器中进行,下图表示在不同反应时间t 时,温度T和压强P与生成物C在混合物中的体积百分含量的关系曲线。
pC(g)在密闭容器中进行,下图表示在不同反应时间t 时,温度T和压强P与生成物C在混合物中的体积百分含量的关系曲线。
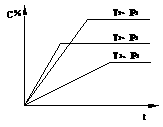
由曲线分析,下列判断正确的是 ( )
A.T1<T2,P1>P2,m+n>p,正反应吸热
B. T1>T2,P1<P2,m+n>p,正反应放热
C.T1<T2,P1>P2,m+n<p,正反应放热
D. T1>T2,P1<P2,m+n<p,正反应吸热
14、在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
13、已知一定温度下合成氨反应:N2 +3 H2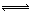 2 NH3 ,ΔH=-92.4kJ·mol-1 ,在恒温、恒容的密闭容器中进行如下实验:①通入1 mol N2和3 mol
H2,达平衡时放出热量为Q1,②通入2 mol
N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
( )
2 NH3 ,ΔH=-92.4kJ·mol-1 ,在恒温、恒容的密闭容器中进行如下实验:①通入1 mol N2和3 mol
H2,达平衡时放出热量为Q1,②通入2 mol
N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
( )
A.Q2 =2Q1 B.Q1 < 0.5 Q2
C.Q1 < Q2 < 184.8 kJ D.Q1 = Q2 < 92.4 kJ
12、反应C(S)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对反应速率几乎没有影响的是
( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对反应速率几乎没有影响的是
( )
A.增加C的量 B.将容器的体积缩小为一半
C.保持体积不变,充入氮气使体系的压强增大
D.保持压强不变,充入氮气使容器的体积增大
11、在一定温度下的定容密闭容器中,发生反应: A(s)+2B(g) C(g)+D(g)
C(g)+D(g)
当下列物理量不再变化时,表明反应已达平衡的是 ( )
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质量 D.气体总物质的量
10、某化学反应其△H= -122 kJ/mol,∆S= 231 J/(mol·K),则此反应在下列哪种情况下可自发进行 ( )
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com