
题目列表(包括答案和解析)
21.下列溶液中有关物质的量浓度关系一定正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(M+) == c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
20.在等温等容条件下有下列气体反应:2A(g)+2B(g) 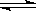 C(g)+3D(g),现分别从两条途径建立平衡:I:A和B的起始浓度均为2mol/L; II:C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是
C(g)+3D(g),现分别从两条途径建立平衡:I:A和B的起始浓度均为2mol/L; II:C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是
A.最终达到平衡时,两个途径所得混合物平均相对分子质量不相同
B.最终达平衡时,体系内同一气体的体积分数相同
C.最终达平衡时,体系内同一气体的浓度相同
D.最终达平衡时,两个途径的反应速率相同
19.有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)
溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
下列有关叙述中,正确的是
A.金属锂作电池的正极,石黑作电池的负极
B.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
18.下列事实能说明醋酸是弱电解质的是
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1 mol/L醋酸的pH比0.1 mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;
⑥0.1 mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
⑧pH=a的溶液的物质的量浓度等于pH=a+1的溶液的物质的量浓度的10倍
A.②⑥⑦⑧ B.③④⑥⑦ C.③④⑥⑧ D.①②
17.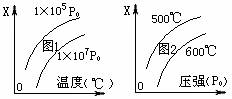 反应3A(g)+B(s)
反应3A(g)+B(s) 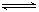 2C(s)+3D(g)+6E(g),△H>0,图象表示温度、压强与该反应中某个量X的关系,下列叙述正确的是
2C(s)+3D(g)+6E(g),△H>0,图象表示温度、压强与该反应中某个量X的关系,下列叙述正确的是
A.图1中的X只能是D的体积百分含量
B.图2中的X可能是A的浓度或体积百分
含量
C.图1中的X可能是C的浓度
D.图2中的X可能是D或E的体积百分含量
16.常温下,将pH=3的强酸溶液和pH=12的强碱溶液混合,当混合液的pH等于11时,强酸与强碱溶液的体积比是:
A.10∶1 B.1∶9 C.9∶2 D.9∶1
15.有镁铝合粉末10.2g,将它溶于500mL 4mol/L的盐酸里,若要使沉淀质量达到最大值,
则需加入2mol/L氢氧化钠溶液的体积为
A.1000mL B.500mL C.100mL D.1500mL
14.对于反应2A2(g)+B(S) 2C(g),能增大正反应速率的措施是
2C(g),能增大正反应速率的措施是
A.加入少量B物质 B.增大容器容积
C.恒容时充入Ar气体 D.恒容时加入适量的C物质
13.将1.12g铁粉加入25mL 20mol·L-1的氯化铁溶液中,充分反应后,其结果是
①铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
②往溶液中滴入无色KSCN溶液,显红色
③Fe2+和Fe3+的物质的量之比为6:1
④氧化产物与还原产物的物质的量之比为2:5
A.①② B.②③ C.③④ D.①④
12.下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO- + H3O+
HCOO- + H3O+
B.CO2+H2O HCO3- + H+
HCO3- + H+
C.CO32- + H2O HCO3- + OH-
HCO3- + OH-
D.HS- + H2O S2- + H3O+
S2- + H3O+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com