
题目列表(包括答案和解析)
2.准确量取25.00mL Na2CO3溶液,可选用的仪器是 ( )
A.50mL容量瓶 B.50mL 量筒
C.25.00mL 酸式滴定管 D.25.00mL碱式滴定管
1.下列气体中不会造成空气污染的是 ( )
A.N2 B.NO C.NO2 D.CO
29.硝酸跟金属反应时,随着硝酸的浓度下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH4+中的一种或几种。现有一定量铁粉和铝粉组成的混合物跟100ml稀硝酸充分反应,反应过程中无任何气体放出,在反应结束后的澄清溶液中,逐渐加入4.00mol/L的氢氧化钠溶液,加入氢氧化钠溶液的体积与产生沉淀的质量如图所示:
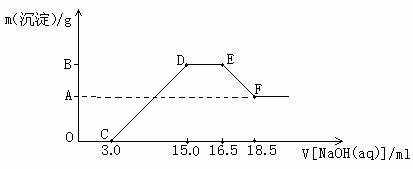
请回答:
(1)应后的溶液中加入NaOH的溶液没有立即出现沉淀的原因
是:______________ __。
(2)跟硝酸反应后的产物中铁元素的化合价是__________。
(3)图形中DEF先平后下折的原因是______________________________________
(4)纵坐标中A点的数值是________________。原稀硝酸的浓度是______________。
28.某学生进行研究性学习的课题为:用中和滴定法测定某烧碱的浓度。请回答他在主要操作过程中的有关问题:
(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器除天平、药匙外,还有___ __、 、
、 ;
(2)滴定:①盛装0.20mol/L的盐酸标准溶液应该用________式滴定管,②滴定时,锥形瓶中加2--3滴酚酞作为指示剂,滴定过程中,一支手控制滴定管活塞,另一支手_____________,眼睛应注视__________ ______ _,当__________时即为滴定终点;③有关数据纪录如下:
|
滴定序号 |
待测溶液体积(单位:mL) |
所消耗盐酸体积(单位:mL) |
||
|
滴定前读数 |
滴定后读数 |
消耗盐酸体积 |
||
|
1 |
20.00 |
0.50 |
20.60 |
V(平)= ________ |
|
2 |
20.00 |
6.00 |
26.00 |
(3)计算:测得NaOH溶液的浓度为 ____________mol/L,烧碱样品的纯度为 _____。
(4)若该学生测定值偏大了,则该同学引起测定误差的可能原因是____________,
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
27.某溶液由Na+ 、Cu2+ 、Fe3+、AlO2- 、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
(1)向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
(2)在(1)所得溶液中加入过量氨水,产生白色沉淀,过滤;
(3)在(2)所得的滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
(4)在(3)所得滤液中加入过量的稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述操作回答下列问题:
(1)原溶液中肯定存在的离子是_______________;
(2)原溶液中可能存在的离子是_______________;
(3)原溶液中肯定不存在的离子是________________。
26.下图为中学化学中常见的物质转化关系图,
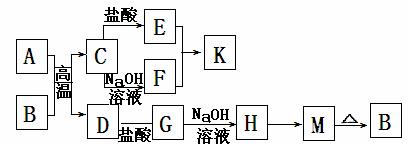
其中A、D为单质,B为红棕色固体,K为白色胶状沉淀,即可以溶于强酸溶液,又可以溶于强碱溶液。
试回答:
(1)写出下列物质的化学式:F ;H 。
(2)写出下列反应的离子方程式(不是离子反应的写化学方程式)
A+B的反应: 。
K和NaOH溶液的反应: 。
E+F的反应: 。
H→M的反应: 。
(3)在实验室中暂时保存G溶液时,一般在溶液中加入少量 和 ,
这样做的目的是 。
25.在体积不变的密闭容器内,N2、H2合成氨反应达到平衡时,容器内有0.15molN2、0.45mol H2、0.35mol NH3。相同条件下,若向该容器中再充入0.15molN2、0.45molH2、0.35mol NH3,则下列叙述正确的是
A.正、逆反应速率同时增大,平衡时密度减小
B.正反应速率增加倍数等于逆反应速率增加倍数,NH3的体积百分含量不变
C.逆反应速率增加倍数大于正反应速率增加倍数,N2的转化率降低
D.重新平衡时N2<0.3mol,NH3>0.7mol


第一学期期中考试
卷Ⅱ(非选择题 共35分)
24.AgNO3固体在加热条件下发生下列分解:2AgNO3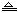 2Ag+2NO2↑+O2↑ 则加热0.02mol
2Ag+2NO2↑+O2↑ 则加热0.02mol
的AgNO3固体至完全分解,用排水集气法将收集到标况下的气体体积为
A.112ml B.672ml C.224ml D.298ml
23.现有反应X(g) + Y(g)
 2Z(g)(正反应为放热反应),右图表示从反应开始到
2Z(g)(正反应为放热反应),右图表示从反应开始到
t1秒时达到平衡,在t2秒时由于条件变化使平衡破坏,到t3秒时又达平衡。则在图中t2秒
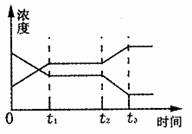 时改变的条件可能是
时改变的条件可能是
A.降低温度
B.使用了催化剂
C.增大压强
.... D.减小了X或Y的浓度
22.据报道,我国拥有完全自主产权的氢氧燃料电池车将在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e- ===4OH-
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2===2H2O
D.氢氧燃料电池可将热能直接转变为电能
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com