
题目列表(包括答案和解析)
19.(10分)(1)(6分)右图分别是温度计、量筒、滴定管的一部分,则:量筒应该是 读数为 mL
滴定管应该是 ,读数为 mL
温度计应该是 ,读数是 ℃
(2)(4分)用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,
下列实验操作会引起测量结果偏高的是 。
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡。
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失
③中和滴定时,锥形瓶内有少量蒸馏水。
④酸式滴定管用蒸馏水洗后,未用标准液洗。
⑤读取滴定管终点读数时,仰视刻度线。
18. 被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌等物质组成的电解液。电池总反应为: Zn + 2 MnO2十H2O = ZnO + 2MnO (OH)。下列说法正确的是
A.该电池的锌极发生的反应为Zn - 2e- = Zn2+
B.该电池反应中二氧化锰起氧化剂作用
C.当 0.lmol Zn 完全溶解时,电池中转移的电子个数为 1.204×l023

 D.电解液中的阴离子流向正极
D.电解液中的阴离子流向正极
17.一定温度下,某密闭容器中发生如下反应:A(g)+B(g)
 C(g) +D(g)
C(g) +D(g)
 H<0。当反应达到平衡时测得容器中各种物质均为amol。欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是
H<0。当反应达到平衡时测得容器中各种物质均为amol。欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是
A.降低温度 B.恒容时,再通入2amolC和2amolD
C.使容器的体积缩小一半 D.恒容时,再通入amolA和amolB
16.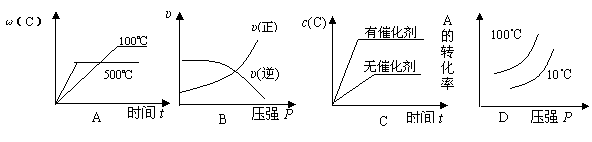 对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是
对于可逆反应:2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是
14.常温下,0.1mol/L Na2CO3溶液中各微粒浓度关系正确的是
A.c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3)
B.c(Na+)>c(CO32-)>c(OH-)>c(H+)
C.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D. c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
15已知在pH值为4左右的环境中,Ca2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
A.加入纯Cu将Fe2+还原为Fe
B.向溶液中通入H2S使Fe2+沉淀
C.向溶液中通入Cl2,再通入NH3,调节pH值为4左右
 D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4左右
D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4左右
13.要将pH=1体积为a mL的盐酸变为pH=2(近似认为不同浓度的盐酸密度相同),下列采取的措施能够达到预期目的的是
A.加热蒸发到溶液体积为0.5a mL B.加入a mL蒸馏水
C.加入10a mL的pH=3的盐酸 D.加入0.5a mL与盐酸相同浓度的NaOH溶液
12.
已知胆矾溶于水使溶液温度降低,室温下将1mol无水硫酸铜制成溶液释放出热量为Q1kJ,又知胆矾分解的热化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(l)
CuSO4(s)+5H2O(l)
ΔH2=+Q2kJ/mol,则Q1 、Q2的关系为
A. Q1 <Q2 B. Q1 >Q2 C. Q1 =Q2 D.无法确定
11. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.在AgCl悬浊液中加入KI溶液充分振荡 Ag+ + I- = AgI↓
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为: Cu2++2e- == Cu
D.钢铁发生电化腐蚀的正极反应式:Fe -2e- == Fe2+
10.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
A.溶液中Ca2+数目减少 B.溶液中c(Ca2+)增大
C.溶液pH值不变 D.溶液pH值增大
9.能使H2O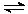 H++OH-电离平衡向正向反应方向移动,而且所得溶液呈酸性的是
H++OH-电离平衡向正向反应方向移动,而且所得溶液呈酸性的是
A.将水加热到100℃,使水pH=6 B.在水中加入氯化铜固体
C.在水中加入小苏打 D.在水中滴入稀H2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com