
题目列表(包括答案和解析)
3.细铁丝在氧气中燃烧或与水蒸气反应的共同产物是 ( )
A.Fe(OH)3 B.Fe3O4 C.Fe2O3 D.FeO
2.下列无色气体中,常温时遇空气很容易变为红棕色的是 ( )
A.NH3 B.NO C.CO2 D.SO2
1.从防止环境污染的角度出发,最理想的能源是 ( )
A.煤 B.氢气 C.天然气 D.石油
26.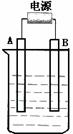 (12分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
(12分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
(1)A接的是电源的 极,B是该装置的 。
(2)写出电解时反应的总离子方程式
。
(3)电解后溶液的pH为多少?要使电解后溶液恢复到电解前的状态,则需加入什么物质,其质量为多少?[写出计算过程](假设电解前后溶液的体积不变)
25.(16分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)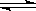 CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的ΔH 0,(填“>”、“<”、或“=”),化学平衡常数的表达式为 。
(2)能判断该反应达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。其它条件不变,升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol·L–1和0.100 mol·L–1,平衡时CO的转化率为
。
24.(12分)⑴常温下取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+)
(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):
c(Cl-)- c(M+)= mol/L,c(H+)- c(MOH)= mol/L。
⑵如果常温下取0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的PH<7,则说明MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
23.(8分)(1)水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为
(2)又已知C (s) + O2(g)=CO (g);△H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l);△H = -285.8kJ·mo1-1
①将2.4 g 炭转化为水煤气,再完全燃烧生成气态水,整个过程的△H =
②由CO、H2在一定条件下可获得汽油的替代品:甲醇,甲醇的燃烧热为726.5 kJ/mol,试写出由CO、H2生成甲醇的热化学方程式 。
22.(10分)I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
 II.①某同学用碳棒、铜棒和稀硫酸为原材
II.①某同学用碳棒、铜棒和稀硫酸为原材
料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在右边画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
21.(9分)(1)证明乙酸溶液中存在电离平衡
①现有pH=3的乙酸溶液、蒸馏水、pH试纸,选用适当的仪器和用品,简述证明乙酸溶液中存在电离平衡的实验方法
。
②根据以下信息,分析并回答相关问题:弱酸弱碱盐溶于水中后,由于弱酸的阴离子和弱碱的阳离子都会发生水解,生成相应的酸或碱。溶液的酸碱性比较复杂,但主要还是由弱酸和弱碱的相对强弱决定。如氢氟酸比一水合氨强,则氟化铵溶液呈酸性;醋酸与一水合氨相当,则醋酸铵溶液显中性;氢氰酸比一水合氨弱,则氰化铵溶液则显碱性。
某学校学生的一次探究实验中发现:在pH约为3的醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象甲、乙两组同学提出了不同的解释:
甲组同学观点:醋酸钠水解呈碱性,因而使溶液的pH增大;
乙组同学观点:醋酸钠电离出大量醋酸根离子,抑制了醋酸的电离,因而pH增大。
为了验证上述哪种观点正确,你认为可以向0.1 mol·L-1的醋酸溶液中加入少量的下列物质中的 (填写编号),然后测定溶液的pH即可。
A.醋酸钾固体 B.醋酸铵固体 C.氨水 D.氯化铵固体
(a)如果甲同学的观点正确,当加入你所选的物质后,溶液的pH (填变大或变小或不变,下同)
(b)如果乙同学的观点正确,当加入你所选的物质后,溶液的pH
20. (10分)乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+
(10分)乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
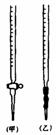
⑴ 滴定时,将KMnO4标准液装在右图中的 (填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是 。
⑶ 通过上述数据,计算出x= 。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com