
题目列表(包括答案和解析)
7.1999年度诺贝尔化学奖获得者艾哈迈德·泽维尔(AhmedH.Ze-wail),开创了“飞秒(10-15s)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术不能观察到的是
( )
A.化学变化中反应物分子的分解 B.反应中原子的运动
C.化学变化中生成物分子的形成 D.原子核的内部结构
6.下列各组粒子中,质子数和电子数都相同的有 ( )
A.H2O和CH4 B.Na和NH4+ C.Mg2+和NH3 D.HF和F-
5.某原子最外层电子数是次外层电子数的1/2,则该原子的核电荷数可能是 ( )
A.6 B.4 C.12 D.14
4.下列微粒的结构示意图中,能表明带二个单位正电荷的阳离子的是 ( )
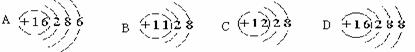
3.下列说法正确的是 ( )
A.相对原子质量就是原子的真实质量 B.相对原子质量越大表示原子本身质量越大
C.相对原子质量是以一种碳原子质量作为标准的一个比值
D.相对原子质量越大表示原子本身质量越小
2.下列关于分子的叙述,正确的是 ( )A.一切物质都是由分子构成的 B.分子是化学变化中的最小粒子。
C.分子是不能再分的粒子 D.分子是保持物质化学性质的最小粒子
1.相同分子数目的H2O、H2SO4、H2、H2CO3中含有相同 ( )
A.氧原子个数 B.氢原子个数 C.氢分子个数 D.氢元素
10.质子数、电子数相等时粒子的表现形式
①质子数相等时:a.同种元素的原子和离子,如O和O2-;b.原子和分子,如O2和S;c.不同的两种分子,如H2O和HF;d.原子和原子团,如F与OH-;e.离子和离子,如F-和OH-;f.分子和离子,如O2和S2-等。由此可见,质子数相同的粒子不一定是同种元素,可能是不同的分子或离子。
②电子数相等时,可以是原子、分子或离子,如10个电子的粒子有:Na+、Mg2+、Al3+、O2-、F-、Ne、NH3、H2O、CH4、HF、OH-、NH4+等。
例题分析:
例题1 1803年,道尔顿(英国)提出原子学说,对化学发展起了推动作用。其主要论点有:①物质是由原子构成的;②原于是微小的不可分割的实心球体;③同种元素的原子的性质和质量都相同。从现代观点看,这三个论点不确切的是 ( )
A.② B.②③ C.①② D.①②③ .
分析:从现代物质结构的观点看,物质不仅是由原子构成的,还可以是由分子或离子构成;原子是化学变化中最小的粒子,但它不是不可分割的实心球体,原子还可分成原予核和核外电子,原子核又可分为质子和中子,原子也不是实心的球体,同种元素的原子的性质和质量不一定相同,因为同种元素的原子虽然质子数相同,但中子数可能不同,因而质量可能不同。因此道尔顿的三个论点都是不确切的。因此选择D。例题2 用下图的原子或离子结构示意图的编号(A、B、C、D、E)填空
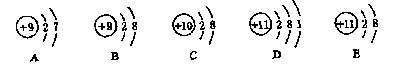
(1)电子层排布相同的是 , (2)属于同种元素的是 ,
(3)属于金属元素的是 , (4)属于稀有气体元素的是 ,
(5)属于阳离子的是 , (6)属于阴离子的是 。
分析:初中阶段我们应该熟悉1-18号元素的原子结构示意图。判断元素种类的根据是:核电荷数(或质子数)是否相同。金属元素原子的最外层电子数一般小于4,非金属元素原子的最外层电子数一般大于等于4,稀有气体元素原子的最外层电子数一般为8(氦为2)。原子显中性时核内质子数等于核外电子数;阳离子带正电荷,核内质子数大于核外电子数;阴离子带负电荷,核内质子数小于核外电子数。因此答案为(1)BCE (2)A和B、D和E (3)D或E (4)C (5)E (6)B
自我评价:
9.构成原子的基本粒子的特点
①质子:决定元素的种类,质子数不同,元素的种类就不同。例如:原子核内质子数为8时,此原子一定为氧原子,属于氧元素。
②最外层电子数:主要决定元素的化学性质,知道最外层的电子数一般可知元素是金属、非金属或稀有气体元素,以及元素的最高正化合价和负化合价。
 金属元素:一般小于4
金属元素:一般小于4
最外层电子数特征 非金属元素:一般大于或等于4
稀有气体元素:一般为8(He为2)
如:硫元素,原子核外有16个电子,最外电子层有6个电子,则可知硫为非金属,最高正化合价为+6,最低负化合价为-2。
③质子和电子:决定原子是否带电。在同一原子中,质子数>电子数,带正电荷;质子数<电子数,带负电荷。如:Na+中,质子数11个,电子数10个,带一个单位正电荷;Cl-中,质子数17个,电子数18,带一个单位负电荷。
8.构成原子的基本粒子间的数量关系:(在原子中)
①质子数=核电荷数=核外电子数=原子序数
②原子核所带的正电量=核外电子所带的负电量
③相对原子质量=质子数+中子数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com