
题目列表(包括答案和解析)
27、(13分)(1)三角锥形 (每空1分) 略 (每空1分) 极性分子(每空1分)
(2)离子键、 共价键 (每空2分) 第二周期ⅤA族(每空2分)
(3)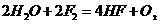
 (每空2分)
(每空2分)
 (4)
(4)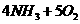
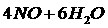 (每空2分)
(每空2分)
(5) 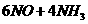 ======
======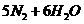 (每空2分)
(每空2分)
26、(15分)、(1) H C O (每空1分)
(2) Al2(SO4)3
(每空2分) 酸(2分) Al3+ +3H2O  Al(OH)3 +3H+(2分)
Al(OH)3 +3H+(2分)
H2SO4(2分) 抑制Al3+的水解(2分)
(3) Al2(SO4)3 (每空2分) H2SO4或H2SO3或H2CO3(其它合理答案也可) (每空2分)
6、A 7、C 8、C 9、D 10、D 11、A 12、A 13、C
29、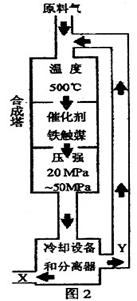 (15分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图2所示。①X的化学式为
;
(15分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图2所示。①X的化学式为
;
②据图2中分析,下列说法正确的是(选填字母序号) ;
A.在此温度下,可提高原料的转化率
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制,选择此条件下压强
D.为提高原料的转化率,采用循环操作
(2)常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水电离出的c(OH-) 10-7mol/L(填写“>”、“<”或“=”);
②若该溶液是由体积相等的盐酸和氨水混合而成,且恰好呈中性,则混合前c (HCl) c (NH3·H2O)(大于、小于或等于,下同),混合后溶液中离子浓度大小关系为 。
3)恒温下,将a mol N2 与b mol H2的混合气体通入一个固定容积的密闭容器中,若反应进行到某时刻t时,n2(N2)=13 mol ,n2(NH3)=6 mol 则a 的值_________
化学理综部份答案
27、(13分)A、B、C、D为四种气态单质,在一定条件下,B可以分别与A、C、D化合生成甲、乙、丙。C和D化合生成化合物丁,丁在空气中放置变成红棕色。已知甲、乙、丙每个分子中含有的电子数相等,且丙能使湿润红色石蕊试纸变蓝,并且各物质之间有如下图所示的转化关系:
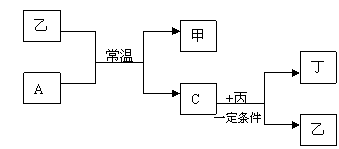

请回答下列问题:
(1)化合物丙的空间构型为____________ 化合物甲的电子式为_______________,乙是 (极性或非极性)分子
(2)化合物甲与丙反应生成的产物中含有的化学键有_____________.D元素在周期表中位置为
(3)单质A与化合物乙反应的化学方程式为_________________________
(4)单质C与化合物丙的反应化学应工业上有重要应用,请写出其化学方程式
(5)丙与丁在一定条件的反应又是该生产中消除尾气污染的一种方法,请写出这其反应的化学方程式________________________________________.
26.(15分) A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,其中只有一种是金属元素,A是原子半径最小的元素。C元素原子最外层电子数是D元素原子最外层电子数的一半,B元素原子的最外层电子数比D的少两个,它是通常形成有机物种类最多的元素。E是地壳中含量最多的元素,与D同主族。
(1)写出A、B、E三种元素的元素符号:A: B: E: 。
(2)五种元素中的金属元素与其余的元素能生成溶于水的盐的化学式为 ,其溶液显 性,其原理用离子方程式表示为 ,实验室配制该溶液时,要加适量的 ,其作用是
(3)五种元素中的三种组成的易溶于水的物质中,能促进水电离的物质M是
(写化学式,写一个即可,下同),能抑制水电离的物质N是 。
13、用0.1mol/l的NaOH溶液滴定100ml 0.1mol/L的盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的PH范围为………………( )
A、6.9-7.1 B、3.3-10.7 C、4.3-9.7 D、6-8
12、有4种物质的量相同且由一价阳离子A+与B+与一价阴离子X-和Y-组成的盐溶液,据测试,常温下AX溶液和BY溶液的PH都为7,AY溶液的PH大于7,BX溶液的PH小于7,据此推知其中可能不水解的盐是……………………………………………( )
A、AX B、BX C、AY D、BY
11、氨水逐滴加到稀盐酸中,使溶液为中性,则此时………………………………( )
A.c(NH4+)=c(Cl-) B.c(NH4+)>c(Cl-)
C.c(NH4+)<c(Cl-) D.c(NH4+)与c(Cl-)之间关系不确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com