
题目列表(包括答案和解析)
31.(8分)一定温度下有①盐酸、②硫酸、③醋酸三种溶液,试回答:
(1)当它们的物质的量浓度相同时,c(H+)由大到小的顺序是_______(填编号,下同)。
(2)同体积同物质的量浓度的三种酸中和NaOH溶液的能力由大到小的顺序是_____。(3)c(H+)相同体积相同时,分别加入足量的锌,相同状况下产生的气体的体积由大
到小的顺序是_______。
(4)将c(H+)相同的三种酸均稀释10倍后,溶液的pH由大到小的顺序是
30.(4分)(1)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L,则该温度下水的离子积Kw=___________,t___________25 ℃(填“>”、“<”或“=”),在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为______________。
(2)某温度下纯水中c(H+)=2×10-7mol/L,则此时溶液中的c(OH-)= 。
27.把0.4mol铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3molNO2 和0.2molNO,下列说法正确的是
A.反应后生成的盐只为Fe(NO3)3 B. 反应后生成的盐只为Fe(NO3)2
C.反应后生成的盐为Fe(NO3)3 和Fe(NO3)2,其物质得量之比为1:3
D. 反应后生成的盐为Fe(NO3)3 和Fe(NO3)2,其物质得量之比为3:1
玉溪一中高2010届高二上学期期末化学考试试题
第II卷 非选择题 (共46分)
26.铁、钴、镍的原子序数分别是26,27,28。它们的性质相似,被称为铁系元素,已知有下列反应方程式:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 和 Co2O3 + 6HCl = 2CoCl2 + Cl2↑ + 3H2O 结合过去所学知识,判断氧化能力从高到低的顺序是
A.Cl2 > Co2O3> Fe2O3 B.Co2O3> Cl2 > Fe2O3
C.Fe2O3 > Co2O3 > Cl2 D.Cl2> Fe2O3 > Co2O3
25.已知某温度下,0.1 mol/L的NaHB强电解质溶液中,c(H+)>c(OH-),则下列各关系式一定正确的是
A.c(Na+)=c(HB-)+2c(B2-)+c(OH-) B.溶液的pH=1
C.c(Na+)=0.1 mol/L≥c(B2-) D.c(H+)·c(OH-)=10-14
24.下列叙述正确的是
A.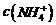 相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:
相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是: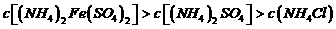
B.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+ +2H2O
C.0.2 mol/L HCl溶液与等体积0.05 mol/LBa(OH)2溶液混合后,溶液的pH=1
D.过量的二氧化碳通入漂白粉溶液中:ClO-+CO2+H2O=HClO+HCO3-
23.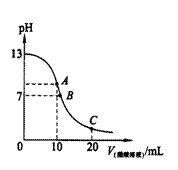 25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,
25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,
不正确的是
A.在A点: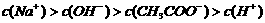
B.在B点: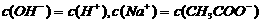
C.在C点: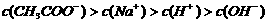
D.在C点: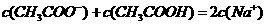
22.在容积相同的A、B两个容器中,分别充人2 mol SO2和1 mol O2,使它们在相同温度下发生反应2SO2(g)+O2(g) 2SO3(g),并达到平衡。在反应过程中,若A容器的体积不变,B容器的压强不变,A中SO2的转化率是a%,B中SO2的转化率是b%,则:a与b的关系是
2SO3(g),并达到平衡。在反应过程中,若A容器的体积不变,B容器的压强不变,A中SO2的转化率是a%,B中SO2的转化率是b%,则:a与b的关系是
A.a>b B.a=b C.a<b D.无法确定
21.把0.6 mol X气体和0.6 mol Y气体混合于2 L的容器中,使它们发生如下反应:
3X(g)+Y(g) nZ(g)+2W(g)5 min末生成0.2 mol W。若测知以Z的浓度变化表示的平均反应速率为0.01
mol·L-1·min-1,则化学反应方程式中的n值为
nZ(g)+2W(g)5 min末生成0.2 mol W。若测知以Z的浓度变化表示的平均反应速率为0.01
mol·L-1·min-1,则化学反应方程式中的n值为
A.4 B.3 C.2 D.1
20.一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
2Z(g)一定达到化学平衡状态的是①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com