
题目列表(包括答案和解析)
35.(6分)(写出简要计算过程)
34.(10分) (1)单质F是_____________。
(2) , 。
(3) 。
。
(4) 。
33.(8分)
(1)显 ,理由是(用离子方程式表示) 。
(2)______0.11 mol/L (填“>”“=”“<”=。)
(3)各种离子浓度由大到小的顺序是 。
32.(10分)
(1)盛放 ;溶液颜色由 变为 ,
(2)物质的量浓度是 ;质量分数是 。
(3)正确的是______________
31.(8分)
(1) (填编号,下同)。(2) 。
(3) 。 (4) 。
30.(4分)(1)Kw=___________,t________25 ℃,______________。
(2) c(OH-)= 。
35.(6分)将一定质量的Mg-Al合金投入100 mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图。计算下列问题:(写出简要计算过程)
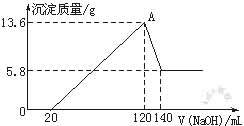 (1)求合金中Mg与Al的物质的量之比?
(1)求合金中Mg与Al的物质的量之比?
(2)所加NaOH溶液的物质的量浓度是多少?
(3)原HCl溶液的物质的量浓度是多少
玉溪一中高2010届高二上学期期末化学考试答题卡
班级 姓名 学号 得分
第II卷 非选择题 (共46分)
34.(10分)已知:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下反应填空:

(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式或化学方程式(是离子反应的只能写为离子方程式) , 。
(3)单质B加强碱溶液生成单质F和溶液K的离子反应方程式是 。
溶液I中和过量的酸后与溶液K相混合可得沉淀J的离子反应方程式是 _______________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是 。
33.(8分)某二元酸(化学式用H2A表示)在水溶液中的电离方程式是:
H2A===H++HA- HA- H++A2-回答下列问题:
H++A2-回答下列问题:
(1)Na2A溶液显_____(填“酸性、中性或碱性”),理由是(用离子方程式表示) 。
(2)若0.1 mol·L-1 NaHA溶液的pH=2,则0.1 mol·L-1 H2A溶液中氢离子的物质的量浓度可能是______0.11 mol/L (填“>”、“=”、“<”。)
(3)0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是_________________。
32.(10分)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实 验。某研究性学习小组在实验室用中和滴定法测定某烧碱的纯度,试根据实验回答有关问题:a.将准确称取的4.4g含少量中性易溶杂质的固体烧碱配成250ml待测液;b.配制0.2000mol/L的盐酸标准液;c.用0.2000mol/L盐酸标准液滴定10.00ml待测液。
(1)滴定时带有玻璃活塞的滴定管盛放 ;以甲基橙为指示剂滴入待测液,当溶液颜色由 变为 ,30秒内不变色,表示达到滴定终点。
(2)根据下表数据计算烧碱溶液的物质的量浓度是 ;原固体烧碱的质量分数是 。
|
滴定次数 |
待测液体积(ml) |
标准酸液的体积 |
|
|
滴定前的刻度(ml) |
滴定后的刻度(ml) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
(3)下列有关说法中正确的是______________
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL 的稀盐酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏大;
E.配制溶液量取较浓盐酸时,若在最后一次读数时俯视读数,则导致实验结果偏大。
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大。
G..若固体烧碱中含杂质Na2CO3,则则导致实验结果偏大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com