
题目列表(包括答案和解析)
2.对同一可逆反应,在一定条件下,无论反应是从正反应开始还是从逆反应开始,或从正、逆反应两个方向开始,最终都能达到完全相同的平衡状态。达到相同平衡时,与起始时反应物及生成物的物质的量配比有关。抓住这一点,有关气体的物质的量无论取何值,都把它转化为最初给定气体的物质的量,若其值与题干给出的量相同,则符合题意。
1.判断某一可逆反应达到化学平衡状态,关键要抓住:①v正= v逆,即反应混合物中有某种物质,在同一时段内消耗的物质的量等于生成的物质的量;②各物质的浓度或质量分数、体积分数不变。题给其他条件都可转化到这两点上来考虑。只要具备这两点之一,便一定是平衡状态;否则,不能确定为平衡状态。
5.速率与平衡的图象分析
主要要抓住三点,即起点、拐点和终点。
 经典题:
经典题:
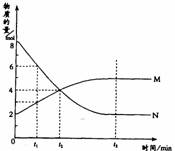
例题1 :(2001年全国高考)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是 ( )
A.反应的化学方程式为:2M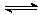 N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
方法:图象分析法。
捷径:从图中得到N为反应物,M为生成物。从0→t2min ,M增加2mol,N消耗4mol,且到达t3min,M、N的浓度保持不变,即反应为可逆反应,反应式为2N 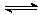 M。t2时反应物和生成物物质的量相等,此时不是正、逆反应速率相等。当t3时正逆反应的速率相等。t1时n(N)=6mol,n(M)=3mol,由于在同一容器中,所以c(N)=2c(M)。因此此题正确答案为D。
M。t2时反应物和生成物物质的量相等,此时不是正、逆反应速率相等。当t3时正逆反应的速率相等。t1时n(N)=6mol,n(M)=3mol,由于在同一容器中,所以c(N)=2c(M)。因此此题正确答案为D。
总结:选项B最容易被误认为正确说法。造成错判的原因有三:①没有看清纵坐标的物理量;②概念错误,认为物质的量相等时,化学反应速率就相等;③没有读懂图。
例题2 :(1998年全国高考)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率 (
)
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率 (
)
A.等于p% B.大于p% C.小于p% D.无法判断
方法:平衡中的等效转化分析法。
捷径:设乙容器压强保持1.01×105Pa,因甲容器中体积保持不变,2SO2+O2 2 SO3的正反应是个气体体积缩小的反应,达到平衡时,混合气体的总压强小于1.01×105Pa。又减小压强,平衡向逆反应方向移动,则甲容器中SO2转化率低,乙容器中(定压)SO2的转化率高。以此得答案为B。
2 SO3的正反应是个气体体积缩小的反应,达到平衡时,混合气体的总压强小于1.01×105Pa。又减小压强,平衡向逆反应方向移动,则甲容器中SO2转化率低,乙容器中(定压)SO2的转化率高。以此得答案为B。
总结:将两平衡态先相联系,再依据平衡移动原理相互转化,便能快速方便获得结果。
例题3 :(2002年全国高考)在一定温度下,向a L密闭容器中加入1 mol X气体和2mol Y气体,发生如下反应:X(g) + 2Y(g) 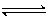 2Z(g)。
2Z(g)。
此反应达到平衡的标志是 ( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为l : 2 : 2
D.单位时间消耗0.1 mol X的同时生成0.2 mol Z
方法:从平衡状态下正逆反应速率相等分析。
捷径:此反应为一气体分子数减小的反应,故容器内压强不随时间变化,说明巳达平衡。各物质的浓度不随时间变化而变化,说明正逆反应速率相等,巳达平衡状态。浓度为一固定比值不能说明巳达平衡。D项中的所述均为正反应,未提到逆反应,故不能判断。以此得答案为AB。
总结:平衡状态的判断,是高考中的重点内容,也是平衡中的重点。此类试题只要抓住平衡状态下速率相等,各成分的百分含量保持不变,即可求解。
例题4 :(1998年全国高考)在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应:2R(g)+5Q(g)= 4X(g)+nY(g)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是 ( ) A.2 B.3 C.4 D.5
方法:根据化学反应直接分析判断,属过量计算。
捷径:本题所述及的反应不是可逆反应。3L气体R和5L气体Q反应时,R过量1L,

同时生成4LX气体和nLX气体,根据题意 ,所以n=2 。
总结:本题若看成是可逆反应,似乎也可以得到相同的答案,但它们之间有严格区别的,若看成是可逆反应,n只能等于1,因为Q气体不能全部参加反应,而Q气体完全反应。该题中n只能等于2。我们把本题安排在可逆反应这一部分中,目的是希望大家能很好地比较两者之间的差异,不能混为一谈。
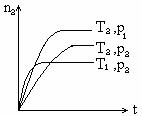
 例题5 :(1997年全国高考)反应2X(g)
+ Y(g) 2Z(g) +热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是(C )
例题5 :(1997年全国高考)反应2X(g)
+ Y(g) 2Z(g) +热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是(C )
A.T1<T2,P1<P2 B.T1<T2,P1>P2
C.T1>T2,P1>P2 D.T1>T2,P1<P2
方法:充分利用关系图,采取淘汰法解题。
捷径:压强相同(P2),达到平衡所用的时间T1小,说明T1反应速率快,所以可知T1﹥T2,C、D可能正确;相同温度时(T2)时,达平衡后Z的物质的量P1大,说明压强为P1时,平衡向生成Z的方向移动。而生成Z的方向是气体体积减小的方法,所以P1﹥P2,所以C项正确。
总结:在图象分析时,既要看清平衡时的直线,又要考虑到非平衡状态下曲线的变化趋势,只有将两者结合起来分析,才能获得正确结果。
 例题6 :(1993年全国高考)在一定温度下, 把2 mol SO2和1 mol O2通入一个一定容积的密闭的容器里, 发生如下反应:
例题6 :(1993年全国高考)在一定温度下, 把2 mol SO2和1 mol O2通入一个一定容积的密闭的容器里, 发生如下反应:
当此反应进行到一定程度时, 反应混和物就处于化学平衡状态。现在该容器中维持温度不变, 令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如果a、b、c取不同的数值, 它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0, 则c= .
(2)若a=0.5, 则b= 和c= .
(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c): 。
方法:此题属等温等容的等效平衡,因两边的气体分子数不等,故要达到等效,必须满足SO2为2 mol和O2为1 mol ( 或通过逆向转换产生) 。
捷径:(1)2 mol SO3相当于2 mol SO2和1molO2
(2)0.5 mol SO2与0.25 mol O2反应生成0.5 mol SO3,再加上1.5 mol SO3,其SO3的量是2 mol,同(1)

 (3)若SO2与SO3物质的量之和等于2,相当于原来加入2 mol
SO2。c mol SO3分解
(3)若SO2与SO3物质的量之和等于2,相当于原来加入2 mol
SO2。c mol SO3分解
得 mol O2,若 +b=1,两者之和等于初始氧气的量就符合题意。
以此得(1)c=2;(2)b= 0.25 ,c= 1.5。(3) a+c=2 ,2b+c=2 。
总结:此题的类型为:在其他条件不变时,改变平衡体系中有关物质的量,使之平衡状态相同。其解题思路是:有关物质的量不论取何值,都把它转化成最初给定的物质的量。若其值与题干给出的量相同,则符合题意。我们把这一类问题称作等效平衡,“等效”是指改变加入的物质与原来加入的物质,在数量上“等效”。
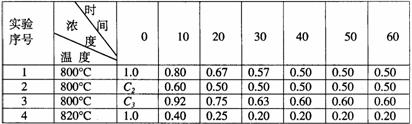
例题7 :(2001年上海高考)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
方法:图表分析法。
捷径: (1)实验1中,反应在10min到20min内的平均反应速率为(0.80 - 0.67)mol·L-1÷10min = 0.013mol·L-1·min-1。
(2)实验1与实验2相比,平衡时的组成保持不变,温度保持不变,所以起始时A的浓度与实验1相同,即1.0mol·L-1,由于实验2的反应速率大于实验1,所以实验2中隐含的反应条件是使用了催化剂。
(3)实验3中,平衡时A 的浓度大于实验1,所以C3应大于1.0 mol/L,在其他条件不变时V3﹥V1
(4)升高温度(从800℃变成820℃)平衡时,A的浓度下降,表明平衡向正反应方向移动,因此正反应为吸热反应。
总结:本题是利用不同时间或不同条件下A的浓度变化值考查化学平衡移动原理,题目设计新颖,尤其是第2问更具特色,利用图象、表格考查化学基础知识是上海试题的特色,也代表当前命题方向和趋势。
例题8 :(1997年上海高考)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
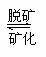
Ca5(PO4)3OH(S) 5Ca2+ + 3PO43- + OH-
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿受腐蚀,其原因是 。
已知Ca5(PO4)3F(S)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因 。
根据以上原理,请你提出一种其他促进矿化的办法: 。
方法:根据题示信息,从平衡移动的角度进行分析。
捷径:细菌和酶作用于食物,生成的有机酸,能中和OH-,使平衡向脱矿方向移动,所以加速腐蚀牙齿。当加入Ca2+或PO43-时,因为Ca5(PO4)3F的溶解度比Ca5(PO4)3OH更小,所以当F-存在时,有利于Ca5(PO4)3F的生成,其反应方程式为:5Ca2+ + 3PO43-+F-==Ca5(PO4)3F↓,又由于它的质地坚固,所以能达到保护牙齿的目的。若增大Ca2+或PO43-的浓度均有利平衡向矿化方向移动。
总结:这是一个贴近生活健康知识的试题。一方面考查化学知识,同时提供了爱护牙齿的方法。这种结合生产,贴近生活。问题是命题的方向。
金钥匙:
 例题1 :在一个6L 的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:4X(g)+ 3 Y(g) 2Q(g)+ nR(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5% ,X的浓度减小1/3,则该反应方程式中的n值是( )
例题1 :在一个6L 的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:4X(g)+ 3 Y(g) 2Q(g)+ nR(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5% ,X的浓度减小1/3,则该反应方程式中的n值是( )
A.3 B.4 C.5 D.6
方法:本题可根据方程式,通过始态、终态的分析求解,但比较繁杂。如能从整体思想来调动思路,考察此题的平衡问题,则很容易发现平衡向体积增大的正反应方向移动了,这样便能迅速获解。
捷径:因达到平衡后,容器内温度不变,X的浓度减小1/3,说明反应向正方向移动,而混合气体的压强比原来增加5% ,又说明正方向为气体物质的量增大的方向。以此方程式中反应物的化学计量数小于生成物的化学计量数,即4+3﹤2+n ,得n﹥5 。故此题正确答案为D 。
总结:该题若纠缠于具体问题的求解,不仅繁杂,而且容易出错。
例题2 :将含1 mol NH3的密闭容器a加热,部分NH3分解并达到平衡,此时NH3的体积百分数为 x % ,若在该容器中加入2 mol NH3后密封,加热到相同温度,使反应达到平衡时,设此时NH3的体积百分数为 y % ,则x和y的正确关系是( )
A.x﹥y B.x﹤y C.x=y D.x≥y
方法:通过设定三倍于原容器的另一假想等效态,然后再将其转化成现状态,分析转化过程中的变化情况即可。
捷径:假设把3 mol NH3先加入容积为a的3倍的容器b中,加热到相同温度,达到平衡时,此时与1 mol NH3加到a容器中属等效态(也即NH3的体积百分数为 x %)。然后再压缩容器,使其变成与a容器等体积,因NH3的分解反应为气体分子数增大的反应,故加压时平衡向逆反应方向移动,达到新的平衡时NH3的体积百分数y % 必大于x % ,则答案为B。
总结:此题如从正面直接分析常会得出错误的判断。但若通过设定另一假想态,进行类比,问题就显得十分明朗。
例题3 :反应2A(g)+3B(g)= 2C(g)+2D(g)在四种不同情况下的反应速率如下:①v(A)= 0.3mol·L-1·s-1,②v(B)= 0.6mol·L-1·s-1 ,③v(C)= 0.48mol·L-1·s-1,④v(D)= 27mol·L-1·min-1。该反应在四种情况下进行的快慢顺序为 。
方法:比较同一化学反应在不同情况下反应速率的快慢,可选用同种物质作基准。然后利用化学反应速率之比等于化学方程式中各物质的化学计量数之比,求出不同情况下,用基准物质表示的化学反应速率,再进行比较。
捷径:选用物质A为基准,将其他物质表示的反应速率换算成用A物质表示的速率。则:②表示的v(A)= 0.6mol·L-1·s-1×2/3 = 0.4mol·L-1·s-1
③表示的v(A)= 0.48mol·L-1·s-1×1 = 0.48mol·L-1·s-1
④表示的v(A)= 27mol·L-1·min-1×1/60 min·s-1×1 = 0.45mol·L-1·s-1
故反应速率的快慢顺序为 ③﹥④﹥②﹥①。
总结:千万不要将不同物质的速率数值进行比较。
 在判断反应速率大小时,当具备了可比性时才能进行比较。即“两个统一”:(1)单位统一,(2)基准物质统一。此类型题目也可不转化为同一物质,可直接根据“各物质的速率比等于方程式中化学计量数比”判断快慢。
在判断反应速率大小时,当具备了可比性时才能进行比较。即“两个统一”:(1)单位统一,(2)基准物质统一。此类型题目也可不转化为同一物质,可直接根据“各物质的速率比等于方程式中化学计量数比”判断快慢。
例题4 :在一定温度下,反应3A(g)+B(g) 2C(g)+2D(g)达到平衡的标志是 ( )
A.单位时间内生成3n mol A,同时生成n mol B
B.单位时间内生成3n mol A,同时生成2n mol D
C.容器内的总压强不随时间的变化而变化
D.容器内气体的平均相对分子质量不随时间的变化而变化
方法: 通过平衡状态的概念,即速率相等进行判断。
捷径:A项,无论在何时,生成的A和B的物质的量之比始终为3︰1,故无法确定是否达平衡。B项,生成3n mol A必消耗2n mol D,同时又生成2n mol D,说明D浓度不变,可由此确定已达平衡。C项,由于反应过程中气体总物质的量不变,故容器内的总压强不随时间变化,不能说明反应是否达到平衡。D项,A、B、C、D都为气体,反应前后气体的总质量、总物质的量不变,故气体的平均相对分子质量始终不变,不能以此判断反应是否达到平衡。以此得答案为B 。
总结:对于反应前后气体的物质的量保持不变的反应,应注意其特殊性,切不可认为当气体压强、气体的平均相对分子质量、气体的密度等不随时间的变化而变化时就一定标志着已达到平衡状态。
例题5 :一定温度下,在一等压密闭容器充入1 mol N2和3mol H2,使反应N2+3H2
 2NH3达到平衡,测得平衡混合气中N2、H2、NH3的物质的量分别为 m mol、n mol、s mol,若维持温度压强不变,只改变初始加入的物质的量,而要求m、n、s的值维持不变,则N2、H2、NH3加入的物质的量用x、y、z表示时,应满足条件:
2NH3达到平衡,测得平衡混合气中N2、H2、NH3的物质的量分别为 m mol、n mol、s mol,若维持温度压强不变,只改变初始加入的物质的量,而要求m、n、s的值维持不变,则N2、H2、NH3加入的物质的量用x、y、z表示时,应满足条件:
(1)若x=0,y=0,则z = 。
(2)若x=0.75mol,则y = ,z = 。
(3)x、y、z应满足的一般条件是(x、y用方程式表示) 。
方法:此题属等温等压的等效平衡,因两边的气体分子数不等,故要达到等效,必须满足N2与H2的物质的量之比为1:3( 或通过逆向转换产生) 。
捷径:(1)若x=0,y=0,开始时只充入NH3,无论NH3充入多少,均满足N2与H2的物质的量之比为1:3,故z为任意值。
(2)考虑N2与H2的物质的量之比为1:3,0.75mol N2必须与2.25mol H2反应,故y = 2.25,z 为任意值。
(3)为满足等温等压的等效平衡,x :y = 1 :3,即y = 3x。z为任意值。
总结:要分清是恒容还是恒压条件下的等效平衡。
例题6 :一定温度下,在恒容的密闭容器中充入 2 mol SO3,发生反应:2SO3(g)
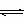 2SO2(g)+O2(g)。达平衡状态时测得SO2的体积分数为 a % 。若在其他条件不变时,再通入 2 mol SO3,待新平衡建立时,测得SO2的体积分数为 b % 。则a与b比较
( )
2SO2(g)+O2(g)。达平衡状态时测得SO2的体积分数为 a % 。若在其他条件不变时,再通入 2 mol SO3,待新平衡建立时,测得SO2的体积分数为 b % 。则a与b比较
( )
A.a﹥b B.b﹥a C.a=b D.无法比较
方法:通过等效假设求解。
捷径:初次反应达平衡后,再充入2 mol SO3,平衡将向正反应方向移动,体系中SO3、SO2、O2的物质的量都增加,因此不易判断前后两次平衡中SO2的体积分数的大小。可作如下等效假设:

旧平衡 平衡Ⅲ 平衡Ⅳ 新平衡
比较平衡Ⅲ和平衡Ⅳ,压缩容器使平衡向逆反应方向移动,故a> b,答案为A。
总结:当遇到新平衡与旧平衡中某量的关系难以直接比较时,可采用等效转化法解题。即假设一个与旧平衡等效的平衡Ⅲ,然后再通过压缩或扩大体积来变为与新平衡等效的平衡Ⅳ,最终通过直接比较平衡Ⅲ和平衡Ⅳ中某些量的关系而得出答案。有的同学认为通入SO3,使平衡右移,SO2的量增多,从而得出b ﹥ a的错误结论,其原因是他们忽略了容器内气体的总物质的量也增大之故。
 例题7 :在一个6L的密闭容器中,放入3L x气体和2L y气体,在一定条件下发生下列反应,4x(g)+ 3y(g) 2Q(g)+ nR(g),达到平衡后容器内温度不变,混合气体的压强比原来增加5%,x的浓度减小1/3,求该反应方程式中的n值。
例题7 :在一个6L的密闭容器中,放入3L x气体和2L y气体,在一定条件下发生下列反应,4x(g)+ 3y(g) 2Q(g)+ nR(g),达到平衡后容器内温度不变,混合气体的压强比原来增加5%,x的浓度减小1/3,求该反应方程式中的n值。
 方法:该题所涉及的数据类型较多,有体积、压强、浓度三种,可先将其转换成同一类型下的变化。如将其转换成物质的量,则题目可变成:“在一个密闭容器中,放入3mol x气体和2mol y气体,在一定条件下发生下列反应,4x(g)+ 3y(g) 2Q(g)+ nR(g),达到平衡后容器内温度不变,混合气体的物质的量比原来增加5%,x的物质的量减小1/3,求该反应方程式中的n值。”这样便很容易求解。
方法:该题所涉及的数据类型较多,有体积、压强、浓度三种,可先将其转换成同一类型下的变化。如将其转换成物质的量,则题目可变成:“在一个密闭容器中,放入3mol x气体和2mol y气体,在一定条件下发生下列反应,4x(g)+ 3y(g) 2Q(g)+ nR(g),达到平衡后容器内温度不变,混合气体的物质的量比原来增加5%,x的物质的量减小1/3,求该反应方程式中的n值。”这样便很容易求解。
捷径:假设将3mol x气体和2mol y气体放入一密闭容器中,则其三态变化为:
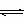 4x(气)+ 3y(气) 2Q(气)+ nR(气)
4x(气)+ 3y(气) 2Q(气)+ nR(气)
开始物质的量(mol) 3 2 0 0
变化物质的量(mol) 1 3/4 2/4 n/4
平衡物质的量(mol) 2 5/4 2/4 n/4
由题意得
2 + 5/4 + 2/4 + n/4 = (3 + 2)× (1 + 5% )
解之得:n = 6
总结:在密闭容器中的压强变化,与压强不变下的体积变化等效,因该题所给数据为体积,故也可根据压强不变,体积改变来运用三态进行分析。
 例题8 :在一密闭的容器中进行反应:N2+3H2 2NH3,反应开始前向容器中加入 5molN2和6molH2,当反应达到平衡时,混合气体总共有10mol,问其中氨气有多少mol?
例题8 :在一密闭的容器中进行反应:N2+3H2 2NH3,反应开始前向容器中加入 5molN2和6molH2,当反应达到平衡时,混合气体总共有10mol,问其中氨气有多少mol?
方法:根据反应前后物质的量之差求解。
捷径:设平衡时氨气的物质量为x 。
 反应前后物质的量差为:(5mol+6mol)-10mol=1mol
反应前后物质的量差为:(5mol+6mol)-10mol=1mol
根据题意和化学方程式N2 + 3H2 2NH3可得:
每生成2mol的NH3,混合气体就减少2mol;现混合气体减少1moL,列比例式为:2mol:2mol= x:1mol,解得x=1mol
该题还可以用同样的方法求解参加反应的N2或H2等。
总结: 此题也可用三态分析法进行计算而获得结果。
例题9 :试用化学平衡原理简要说明浓硝酸跟铜反应生成NO2和稀硝酸跟铜反应生成NO的原因 。
方法:寻找一个平衡体系,再对其进行分析比较。
 捷径:根据题意,首先找出一个化学平衡,即3NO2+H2O 2HNO3+NO,然后根据化学平衡原理进行分析。即增大HNO3的浓度,将使平衡向生成NO2的方向移动,减少HNO3的浓度,将使平衡向生成NO的方向移动。以此浓硝酸跟铜反应生成NO2,稀硝酸跟铜反应生成NO。
捷径:根据题意,首先找出一个化学平衡,即3NO2+H2O 2HNO3+NO,然后根据化学平衡原理进行分析。即增大HNO3的浓度,将使平衡向生成NO2的方向移动,减少HNO3的浓度,将使平衡向生成NO的方向移动。以此浓硝酸跟铜反应生成NO2,稀硝酸跟铜反应生成NO。
总结:该题易出现的错解是:“浓硝酸中硝酸多,铜少,N的化合价降得少,生成NO2,稀硝酸中硝酸少,铜多,N的化合价降得多,生成NO 。”该题出错的原因是未能看清题目“用化学平衡原理”,而另起炉灶用硝酸和铜量的多少来进行分析。事实上,在浓硝酸中即使加入大量的铜,一开始也生成NO2,同样在稀硝酸中即使加入少量铜片,也不会产生NO2。
聚宝盆:
4.等效平衡的分析
主要有等温等容和等温等压两种情况。
3.化学平衡移动的分析
影响因素主要有:浓度、压强、温度,其移动可通过勒沙特列原理进行分析。化学平衡移动的实质是浓度、温度、压强等客观因素对正、逆反应速率变化产生不同的影响,使V正≠V逆,原平衡状态发生移动。
2.化学反应速率的计算与分析
要充分利用速率之比等于化学方程式中的计量数之比。
1.化学平衡状态的判断
化学反应是否达到平衡状态,关键是要看正反应速率和逆反应速率是否相等及反应混合物中各组分百分含量是否还随时间发生变化。
23. (8分)已知一定温度和压强下,在容积为VL的密闭容器中充入1mol
A和1mol B,保持恒温恒压下反应:A(g) +
B(g)  C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______。
A. 一定向正反应方向移动 B. 一定向逆反应方向移动
C. 一定不移动 D. 不一定移动
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则反应达到平衡时,C的体积分数为_______;容器的容积为_______。
22.(10分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________, K值大小与温度的关系是:温度升高,K值_________________。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0-4min的平均反应速率v(CO)=_________mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0-4min的平均反应速率v(CO)=_________mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|

(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min-5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min-6min之间数值发生变化,可能的原因是_________ (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
21. (12分)在一定条件下,可逆反应A2(g)+B2(g)  2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol•L-1, c(B2)=0.1mol•L-1,c(C)=1.6mol•L-1。若A2、B2、C的起始浓度分别为a mol•L-1、b mol•L-1、g mol•L-1请确定:
2C(g)在一个密闭容器中达到平衡时,测得c(A2)=0.5mol•L-1, c(B2)=0.1mol•L-1,c(C)=1.6mol•L-1。若A2、B2、C的起始浓度分别为a mol•L-1、b mol•L-1、g mol•L-1请确定:
(1)a、g应满足的关系式为_________。
(2)若反应从正反应方向开始进行,当g=_________,a有最大值为_________。
(3)若反应从逆反应方向开始进行,当b=_________,a有最小值为_________。
(4)b的取值范围为________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com