
题目列表(包括答案和解析)
12.(1)2 (2)0.8mol/L (3)60% (4)0.2mol/(L·min) (5)不变
(6)B、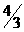
11.(1)0.005mol/(L·s) (2)10% (3)0.2 75%
10.(1)2,1,3,2 (2)气,固或液,气 (3)放热
9.(1)减小 正 增大 (2)放热 较低 (3)50% 16.7% 33.3%
8.(B)温度低 反应慢 却先到达平衡且SO3%反而低
(C)温度低 反应慢 先到达平衡 温度高 反应快 反而后达到平衡
(D)不同温度 同时到达平衡 SO3%反而高
1.D 2.BC 3.AC 4.D 5.BC 6.C 7.A
12.在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器
中,发生如下反应:3A(气)+B(气)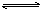 x(气)+2D(气),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4mol/L,请填写下列空白:
x(气)+2D(气),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________;
(2)B的平衡浓度为____________;
(3)A的转化率为________;
(4)生成D的反应速率为____________;
(5)如果增大反应体系的压强,则平衡体系中C的质量分数________(填增大、减小或不变);
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各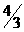 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入______物质____mol。
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入______物质____mol。
大检阅:
11.在一定温度下,把0.5mol N2O4充入体积为5L的密闭容器中, 2s后,NO2的浓度为 0.02mol/L, 60s时达到平衡。此时容器内的压强是开始时的1.6倍。
(1)2s时用N2O4浓度的变化表示反应速度是________。
(2)2s时体系内压强为开始压强的________倍,此时N2O4的分解率为________。
(3)达到平衡时,平衡混合物中N2O4的物质的量为________mol;NO2所占的体积为________%。
10.将等物质的量的A、B、C、D四种物质混合,发生反应:aA+bB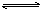 cC(固)+dD。当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol,此时达到化学平衡。
cC(固)+dD。当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol,此时达到化学平衡。
(1)该化学方程式中各物质的系数为:a=_____,b=_____,c=_____,d=_____
(2)若只改变压强,反应速度发生变化,但平衡不发生移动,该反应中各物质的聚集状态为:A________,B________,C________
(3)若只升高温度,反应一段时间后测知四种物质的量又相等,则该反应为________(填“放热”或“吸热”)反应。
9.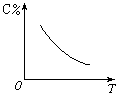 在密闭容器内进行以下反应:3A(g)+B(g) 2C(g)
在密闭容器内进行以下反应:3A(g)+B(g) 2C(g)
(1)正反应是气体体积____的反应,增大压强,平衡向____反应方向移动。C的质量分数____。
(2)压强不变,升高温度,C的质量分数随温度变化的曲线如右图所示。
则上述的正反应是____反应,要提高B的转化率,应该采取____温度。
(3)若反应开始时,A与B的体积比为3:1,平衡时B的转化率为50%,则各组分的质量分数分别为A____、B____、C____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com