
题目列表(包括答案和解析)
7. (2008广东,5)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-==Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B. ②③ C. ②④ D. ③④
6. 下图所示的装置能够组成原电池的是( )
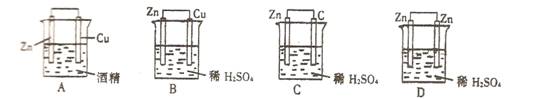
5. 下在铜一锌一硫酸构成的原电池中,当导线中有1mol电子通时,理论上的两极变化是( )
①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1 gH2 ④铜片上析出1mol H2
A. ①③ B. ①④ C. ②③ D. ②④
4. 理论上不能设计为原电池的化学反应是( )
A.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H<0
B.HNO3(aq)+NaOH(aq)==NaNO3(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)==2H2O(l) △H<0
D.2FeCl3(aq)+Fe(s)==3FeCl3(aq) △H<0
3. 对于原电池的电极名称,叙述有错误的是( )
A. 发生氧化反应的一极为负极 B. 正极为电子流人的一极
C. 比较不活泼的金属为负极 D. 电流流人的一极为正极
2. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )

A. 两烧杯中铜片表面均无气泡产生 B. 甲中铜片是正极,乙中铜片是负极
C. 两烧杯中溶液的pH均增大 D. 产生气泡的速度甲比乙慢
1. 下列关于原电池的叙述正确的是( )
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池是将化学能转变为电能的装置
C. 在原电池中,电子流出的一极是负极,该电极被还原
D. 原电池放电时,电流的方向是从负极到正极
23.(17分)实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ (滴定时,1 mol (CH2)6N4H+与l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I称取样品1.500 g。
步骤II将样品溶解后,完全转移到250 mL 容量瓶中,定容,充分摇匀。
步骤Ⅲ移取25.00 mL 样品溶液于250 mL 锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min 后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色
(2)滴定结果如下表所示:
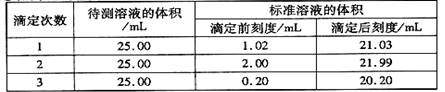
若NaOH标准溶液的浓度为0.1010 mol·L-1 ,计算该样品中氮的质量分数。(写出计算过程)
22.(17分)某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验:
实验一 实验二
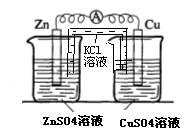
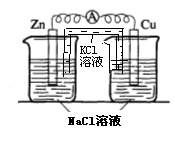
实验三 实验四
结果:
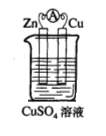
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是(指参加原电池反应的锌占反应总量的百分率): 。
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌的电子不能持续通过导线流向铜极给Cu2+? 。
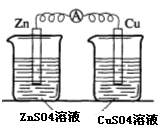
(3)实验三中盐桥中K+流向 溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10-3mol/s,则K+的迁移速率为 mol/s。
(4)实验四中电流计指针有偏转,写出铜极的电极反应式:
21. (10分)已知化学反应N2+3H2=2NH3的能量变化如图所示,
(10分)已知化学反应N2+3H2=2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2)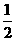 N2(g)+
N2(g)+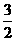 H2(g)=NH3(g) △H =
H2(g)=NH3(g) △H =
(3)N2(g)和H2(g)生成NH3(1)的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com