
题目列表(包括答案和解析)
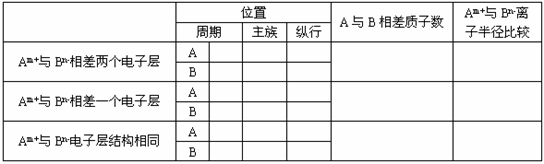
12、(12分)原子序数介于11-35之间的两种主族元素A、B的离子分别为Am+和Bn-,填写下表
11、(9分)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n-m≥0)时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n-m<0)时,该元素属于非金属元素。试回答:
(1)第n周期(n≥2)有______种主族金属元素,有________种非金属元素。
(2)第m主族(m>1)有_________种非金属元素。
(3)根据每周期最后一个金属元素出现的族序数,预测原子序数最大的金属元素将在第________周期_______族
(4)根据周期表中每个周期非金属元素的种数,预测周期表中应有_________种非金属元素(含零族元素),还有_____种未发现,未发现的非金属处在第______周期_______族
10、(11分)已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍
(1)请写出元素符号X_________,Y_________,Z_________,W________
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为
_____________________;E的水溶液显______性,原因可表示为______________________;E在催化剂存在的条件下,可用于还原汽车尾气中的_____________以减少对大气的污染。
(3)这四种元素可组成原子个数比为5:1:1:3的化合物,该化合物的水溶液与足量烧碱溶液混合反应的离子方程式为___________________________________________
(4)将9克Y单质在足量W单质中燃烧,所得气体通入1L1mol/L的烧碱溶液中,完全吸收后,溶液中的溶质及其物质的量分别为_______________________________
9、(2分)某二价金属跟足量盐酸反应产生0.5g氢气,生成的氯化物中共有11.5mol电子,则该金属在周期表中的位置是____________________
8、(4分)元素周期表中前7周期的元素数目如下表所示:
|
周期数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
元素数 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
(1)第6、7周期比第4、5周期多了14种元素,其原因是______________________________。
(2)周期表中________族所含元素最多,________族元素形成化合物种类最多。
(3)请分析周期数与元素数的关系,预言第8周期最多可能含有元素种数为________。
A.18 B.32 C.50 D.64
7、( )如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的7/10,则下列说法中不正确的是
A.原子半径由大到小排列顺序Z>Y>X

 B.Y元素的两种同素异形体在常温下都是气体
B.Y元素的两种同素异形体在常温下都是气体


 C.最高价氧化物对应水化物的酸性W>Z
C.最高价氧化物对应水化物的酸性W>Z
D.阴离子半径由大到小排列顺序Z>W>X>Y
6、( )A和M为两种元素,已知A位于短周期,且A2+与M-的电子数之差为8,则下列说法正确的是
A.A和M的原子序数之差为6 B.A和M原子的最外层电子数之和为9
C.A和M原子的最外层电子数之差为7 D、A和M原子的电子总数之和可能为11
5、( )a、b、c、d、e 是同周期的五种主族元素, a 和 b 的最高价氧化物的水化物显碱性,且碱性 b>a , c 和 d 的气态氢化物的还原性 d>c , e 为金属元素。五种元素的原子得失电子后所形成的简单离子中, e 的离子半径最小,则它们的原子序数由小到大的顺序是
A、baedc B、edabc C、abdce D、ebadc
3、( )已知A、B是第一周期以外的短周期元素,它们可以形成离子化合物AmBn。在此化合物中,所有离子均能形成稀有气体原子的稳定结构。若A的核电荷数为a,则B的核电荷数不可能为
A、a+8-m-n B、a+18-m-n C、a+16-m-n D、a-m-n
( ) 4、在元素周期表中的前四周期,两两相邻的5种元素如图所示.若B元素的核电荷数为a,则5种元素的核电荷总数之和可能为①5a;②5a+18;③5a+10;④5a+8.
4、在元素周期表中的前四周期,两两相邻的5种元素如图所示.若B元素的核电荷数为a,则5种元素的核电荷总数之和可能为①5a;②5a+18;③5a+10;④5a+8.
A.只有①,③ B.只有① C.只有③ D.全部
( ) 1、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
1、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物的稳定
D.Y元素的非金属性比W元素的非金属性强
2、( )下列推断中,符合实际的是
A、第n周期的最后一种金属元素位于第n主族(n>1)
B、第n周期有(8-n)种非金属元素(n>1)
C、若元素原子最外层电子数为m,电子层为n,则m-n=5的主族元素最高价含氧酸为最强酸
D、短周期元素中最外层电子数为2的元素一定是第ⅡA族元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com