
题目列表(包括答案和解析)
28.(4分)在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯钡溶液,所观察到的现象是____________________________________________,其原因是(以离子方程式和简要文字说明):_______________________________________。
27. (10分)如右图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
(10分)如右图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
(1)a为电源的 极。
(2)写出电极反应方程式:A ,B 。
(3)如果想使反应溶液恢复到原来状态,应该加入 ,加入 g。
26.(12分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点? __________________________ 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 <计算出结果到小数点后二位) mol/L
25.X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为
A.X>Z>Y>M B.X>Y>Z>M
C.M>Z>X>Y D.X>Z>M>Y
24.一定条件下将2mol
SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2 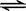 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
(
)
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
(
)
A.2 mol SO2 + 1 mol O2 B.2 mol SO2 + 1 mol O2 + 2 SO3
C.4 mol SO2 + 1 mol O2 D.3 mol SO2 + 0.5 mol O2 + 1 SO3
23. 下列混合溶液的pH一定小于7的是
A. pH=3的盐酸和pH=11的氨水等体积混合
B. pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C. pH=3的醋酸和pH=11的的氢氧化钡溶液等体积混合
D. pH=3的硫酸和pH=11的氨水等体积混合
22.氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的NaOH转变为Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂;盐酸浓度的测定结果会
A.偏低1% B.偏高1% C.偏高0.1% D.无影响
21.应2X(g)+Y(g) 2Z(g);△H<0(正反应为放热反应)
2Z(g);△H<0(正反应为放热反应)  在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是
在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是
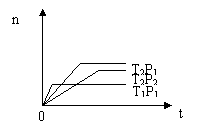 A.T1<T2,P1<P2
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
20..1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是
A.电解质AgNO3溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标况)
C.转移1.204×1022个电子
D.反应中有0.01mol的Ag被氧化
19.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ B.2Fe+2H2O+O2=2Fe(OH)2↓
C.2H2O+O2+4e-=4OH- D.Fe-3e-=Fe3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com