
题目列表(包括答案和解析)
23. (8分)已知:
(8分)已知:
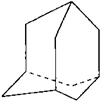
在油田开采的石油中,通常溶有一种碳氢化合物,其分子的立体结构如图所示(该图为键线式)
⑴由图可知其化学式为 。
⑵该笼状结构有 个六元碳环构成,其中有 个碳原子为三个环共有。
⑶该物质的一氯代物有 种。
⑷将0.1mol该物质在一定量O2中燃烧,两者恰好反应完全,生成的气体产物再通过碱石灰吸收,碱石灰增重40.8g,则消耗O2的物质的量为多少?
2008-2009学年第一学期期末调研考试
22.(16分)
Ⅰ.(4分)铜与稀硝酸反应的离子方程式为________________;在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是________________;为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是________________。
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②量取15.00 mL 1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL。
请你参与实验并回答下列问题:
(1)量取15.00 mL 1 mol·L-1盐酸和醋酸溶液所用的仪器是 ;
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是 ;步骤④中检查该装置气密性的操作与观察方法是:____________________;步骤⑤中应记录的数据是 ;
(3)本实验装置丙中量筒的规格是 (填序号)。
A.10mL B.100 mL C.200 mL D.500 mL
(4) 若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=____;(5)试简述速率不等的原因是_________;铜丝不与酸接触的原因是_______________。
(6)试写出镁与醋酸溶液反应的离子方程式: 。
21.(12分)如图所示,A-J分别表示中学化学中常见的一种物质,其中A为难熔的主族元素的氧化物,B为黑色晶体。它们之间的相互关系如下:
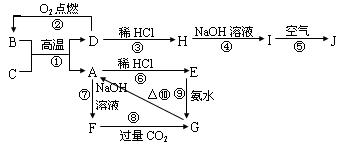
⑴请写出下列物质的化学式:B 、 F ;
⑵请写出反应①、⑤的化学方程式:① 、⑤ ;
⑶写出反应⑨的离子方程式 ;
⑷电解熔融的A物质可生成C物质和O2,若反应过程中生成2mol O2,则同时生成
molC物质。
20.(4分)某百货大楼热销新型“海尔”牌热水器,为延长内胆(钢板制)的使用寿命,采用内胆焊接金属镁棒新技术,此技术利用了原电池原理,可以防止内胆的锈蚀。试写出该原电池的电极反应式:
负极:___________________________;
正极:___________________________。
19.(6分)某可溶性盐化学式为XY(其中X+为阳离子;Y-为阴离子),将一定量的该盐溶于足量的水中,测定溶液的pH。
⑴若测得溶液的pH为3,则该盐溶液中离子浓度大小关系为__________________。
⑵若测得溶液的pH为11,则该盐与水反应的离子方程式为______________________。
⑶若测得溶液的pH为13,则取0.1mol/L的HY溶液100mL中和等浓度的NaOH溶液至中性,所需NaOH溶液的体积_____100mL(填“>”、“<”或“=”)。
18. (3分)t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(3分)t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
⑴从开始反应至达到平衡状态,生成C的平均速率为:_______________;
⑵x=_______。
17.(4分)有下列反应:
①由乙烯制乙醇 ②甲烷在空气中燃烧 ③由乙炔制氯乙烯 ④丙烯使溴水褪色 ⑤由乙醇制乙烯 ⑥用丙烯制聚丙烯 ⑦由乙醇制溴乙烷
其中属于取代反应的是(填序号,下同) ,属于加成反应的是 。
31.将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+
B(g) xC(g) + 2D(g),经5min后测得D的浓度为0.5mol/L,c (A)∶c(B)=3∶5,C的平均反应速率是0.1mol/(L·min)。求:(1)此时A的浓度及反应开始前放入容器中A、B物质的量;(2)B的平均反应速率;(3)x值是多少?
xC(g) + 2D(g),经5min后测得D的浓度为0.5mol/L,c (A)∶c(B)=3∶5,C的平均反应速率是0.1mol/(L·min)。求:(1)此时A的浓度及反应开始前放入容器中A、B物质的量;(2)B的平均反应速率;(3)x值是多少?
理科附加题:(10分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应。各物质的起始加入量如下:A、B和C均为4.0 mol,D为6.5 mol,F为2.0 mol,设E为x mol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置。请填写以下空白:
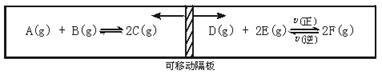
(1)若x=4.5,则右侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使起始反应维持向该方向进行,则x的最大取值应小于__________。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?__________(填“相等”“不相等”或“不能确定”)。其理由是_______________________。
30.(1)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为_________
表示该中和热的热化学方程式为___________
(2)向1L1mol·L-1的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的关为
29.(8分) 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化关系曲线如图所示。

(1)由图中的数据分析,该反应的化学方程式为 ___________
(2)反应开始至2min、5minZ的平均反应速率为 、 ;
(3)5min后Z的生成速率比5min末Z的生成速率 (大、小、相等)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com