
题目列表(包括答案和解析)
4.对于A2 +
3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.v(B2) = 0.8mol·L-1·s-1 B.v(A2) = 0.4mol·L-1·s-1
C.v(C) = 0.6mol·L-1·s-1 D.v(B2) = 42mol·L-1·min-1
3.决定化学反应速率的主要因素是
A.反应物的浓度 B.反应温度
C.使用催化剂 D.反应物的性质
2.下列关于原电池的叙述正确的是
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
1.1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是
A.C(s)+O2(g)=CO2(g) △H =+393.5 kJ/mol
B.C(s)+1/2O2(g)=CO(g) △H =-393.5 kJ/mol
C.C+O2=CO2 △H =-393.5 kJ/mol
D.C(s)+O2(g)=CO2(g) △H =-393.5 kJ/mol
34.(8分)在一定温度下,向一个容积不变(1 L)的密闭容器中,加入3 mol PCl3和4 mol Cl2使之发生反应PCl3(g)+Cl2(g)
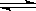 PCl5(g),平衡时容器内压强为开始时的
PCl5(g),平衡时容器内压强为开始时的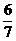 。
。
计算并回答:
(1) 平衡时,容器内气体密度是开始时的________倍,气体平均相对分子质量是开始时的________倍。
(2)保持同一反应温度,若将起始物改为a mol PCl3,b mol Cl2,c mol PCl5。欲使平衡时PCl5的体积分数为 ,则a,b,c满足的关系为
,
。
,则a,b,c满足的关系为
,
。
欲使开始时反应向逆方向进行,则a的取值范围为 , b的取值范围为 ,c的取值范围为
(3) 保持同一反应温度,若将起始物改为3 mol PCl3,3 mol Cl2,达到平衡时PCl3的转化率为__________(百分数表示,保留一位小数;已知: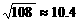 )
)
实验中学2008-2009学年度第一学期期中考试高二化学试卷
33.(12分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和另一种常见气体。进一步研究NH3生成量与温度的关系(其它条件均相同),部分实验数据见下表:
|
T/K |
303 |
313 |
323 |
|
平衡时NH3的生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
回答下列问题:
(1)写出该反应的化学方程式___________________________________________________
(2)该反应的焓变△H______0(填“>”、“<”或“=”)
(3)请在答题纸的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(4)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(5)已知:
N2(g) + 3H2(g) == 2NH3(g) △H = -92.4 kJ/mol
H2(g) + Cl2(g) == 2HCl(g) △H = -184.6 kJ/mol
½ N2(g) + 2H2(g) + ½Cl2(g) == NH4Cl(s) △H = -313.6 kJ/mol
① 计算NH3(g) + HCl(g) == NH4Cl(s)的反应焓变:△H =______________
② 室温下NH3就和HCl能发生化合反应生成NH4Cl;而在加热的条件下,NH4Cl则能分解为NH3和HCl。请用所学的化学原理解释这一现象:____________________________
32.(12分)在容积为2.0 L的密闭容器中充入0.60 mol X和1.60 mol Y,发生反应:
aX(g)+3Y(g)  2Z(g)
2Z(g)
经过10 min反应达到平衡状态,Y的浓度为0.2 mol/L,Z的物质的量分数为 。
。
计算并回答:
① 10分钟内,Z的平均反应速率为 _______________
② 计算a 的值(要求有具体过程)
③ 该条件下X的平衡转化率_____________________(百分数表示,保留一位小数)
④ 该条件下反应2Z(g)  aX(g)+3Y(g)的平衡常数为___________
aX(g)+3Y(g)的平衡常数为___________
⑤ 将体积比为 1︰3的X和Y的混合气体,通入上述密闭容器中, 在一定的条件下发生反应,达到化学平衡时,混合气体中A 的体积分数为 w %(w < 25), 则混合气体中Z的体积分数是 ________,容器内的压强为反应前的 _________ 倍。
B卷(附加题 20分)
31.(3分)已知,常温下1体积水能溶解2体积氯气,并且氯水中有如下平衡:
Cl2 + H2O  HCl + HClO
HCl + HClO
(1)常温下,在一个体积为100mL的透明玻璃针筒里吸入80mL氯气后,再吸进10mL水,振荡后静置。写出针筒中观察到的现象是_____________________。
(2)将上述针筒长时间放置,又能看到何种变化__________;试用平衡观点加以解释__________。
30.(12分)某学习小组通过测定大理石与硝酸反应过程中体系质量的变化,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量均为25.0 mL、大理石用量均为10.00 g。
(1)请完成以下实验设计:
|
实验目的 |
实验编号 |
T / K |
大理石规格 |
c(HNO3) mol/L |
|
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) |
① |
298 |
粗颗粒 |
2.00 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
(2)实验①中CO2质量随时间变化的关系见下图:


忽略溶液体积变化,计算实验①在40s-100 s范围内HNO3的平均反应速率(保留2位小数):_________________。
(3)请在答题纸上,画出实验②和③中CO2质量随时间变化关系的预期结果示意图。
29.(4分)在100℃和200kPa的条件下,反应aA(g)  bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步压缩体系的体积,增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步压缩体系的体积,增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
|
压强(kPa) |
200 |
500 |
1000 |
|
B的浓度(mol/L) |
0.04 |
0.1 |
0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡 移动(填“正向”或“逆向”或“不”),理由是 。
(2)压强从500kPa增加到1000kPa时,平衡 移动(填“正向”或“逆向”或“不”),其原因可能为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com