
题目列表(包括答案和解析)
16. 今有反应2A(g)
今有反应2A(g)  B(g)+C(g)
ΔH>0。 从反应开始到t1 s时达到平衡状态,在t2 s时,由于条件变化使平衡破坏,到t3 s时又达平衡,下图表示在上述过程中物质浓度与反应时间的关系,试判断图中引起
B(g)+C(g)
ΔH>0。 从反应开始到t1 s时达到平衡状态,在t2 s时,由于条件变化使平衡破坏,到t3 s时又达平衡,下图表示在上述过程中物质浓度与反应时间的关系,试判断图中引起
t2~t3变化的是( )
A.降低温度
B.增大压强
C.加大B或C的浓度
D.使用了催化剂
15.只用一种试剂就可以鉴别FeCl3、AlCl3、MgCl2 、NH4Cl和 NaCl五种物质的溶液,这种试剂是( )
A. 氢氧化钠溶液 B.盐酸 C. 氨水 D.硫氰化铵溶液
14. 当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2 (s) Mg2++2OH-,为使Mg(OH)2固体的量减少,可加入
( )
当Mg(OH)2固体在水中溶解达到平衡时:Mg(OH)2 (s) Mg2++2OH-,为使Mg(OH)2固体的量减少,可加入
( )
A. NH4NO3 B. Na2S C. MgSO4 D. CH3COONa
13. 可逆反应:3A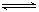 3B+C,△H>0 ,已知反应物A为气态物质,随着温度升高,三营体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是
( )
3B+C,△H>0 ,已知反应物A为气态物质,随着温度升高,三营体系中气体的平均相对分子质量有变小趋势,则下列判断中,正确的是
( )
① B和C可能都是固体 ②B和C一定都是气体
③ 若C为固体,则B一定是气体 ④ B和C可能都是气体
A.只有①② B. 只有②③ C. 只有①④ D.只有③④
12.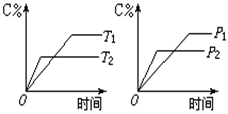
 有可逆反应mA(s)+nB(g) pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是 ( )
有可逆反应mA(s)+nB(g) pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是 ( )
A.到达平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后增大A的量,有利于提高A的转化率
D.化学方程式中一定是n>p+q
11.下列离子方程式的书写中,正确的是 ( )
A . 过量的NaHSO4与Ba(OH)2溶液反应: Ba2++ OH-+ H++SO42-= BaSO4↓+ H2O
B. NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-= NH3↑+H2O
C. 碳酸氢钠溶液中滴入稀盐酸: HCO3- +H+ = CO2 +H2O
D . FeBr2溶液中通入过量Cl2: 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
10.下列变化过程中,熵变的数值是正值,(即熵增加)的是 ( )
A. 1molH2O(g)→1molH2O(l)
B.
 NaCl(s) Na+(aq)+Cl-(aq)
NaCl(s) Na+(aq)+Cl-(aq)
C. 2H2(g)+O2(g) =2 H2O(l)
D.NH3(g)+ HCl(g) = NH4Cl(s)
9.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即可构成CH4燃料电池。已知通入CH4的一极,其电极反应式是:CH4+10OH--8e-= CO32-+7H2O;通入O2的另一极,其电极反应式是:
O2+2H2O+4e-= 4OH-,该电池放电时,下列有关叙述中,不正确的是( )
A.通入CH4的电极为负极 B.正极发生氧化反应
C.燃料电池工作时溶液中的阴离子向负极移动 D.该电池使用一段时间后应补充KOH
8.关于工业合成氨的叙述中,错误的是( )
A.在动力、设备、材料允许的情况,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中N2、H2 的循环利用可提高其利用率,降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
7. 某学生设计了如图所示的方法,鉴定盐(纯净物)甲的组成成分,由此分析,下列说法中,正确的是( )

A.甲中一定有Fe3+ B.丙中一定有Fe3+
C.乙为AgI沉淀 D.甲一定为FeBr2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com