
题目列表(包括答案和解析)
4.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的金刚石与石墨完全燃烧,放出的能量一样多
D.等质量的金刚石与石墨完全燃烧,石墨放出的能量多
3.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
2、下列反应中生成物总能量高于反应物总能量的是: A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
1、下列说法正确的是:
A.化学反应不一定有分子碰撞
B.发生有效碰撞的分子是活化分子
C.化学反应一定需要活化能
D.要普通分子具有合适的取向就能产生有效碰撞
30.(12分)某化学课外活动小组对金属铜、铝的单质和化合物的性质进行研究。
 (1)为测定一定质量的铜铝混合物中铜的质量分数,设计下面两个实验方案:
(1)为测定一定质量的铜铝混合物中铜的质量分数,设计下面两个实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积

方案Ⅱ:铜铝混合物 测定剩余固体的质量
问题讨论:
①小组成员一致认为两个方案都可行,你认为在实验室中选择方案 更便于实施。(填“Ⅰ”或“Ⅱ”)
②小组成员一致认为两个方案中可供选择的溶液A和B有很多,你认为在两个方案中溶液A和B均可选用的是 。(填标号)
A.稀盐酸 B.氢氧化钠溶液 C.硫酸铜溶液
(2)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
(1)将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
(2)反应结束后分离出溶液备用 |
|
|
(3)红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
问题讨论:
①根据实验步骤(1)中实验现象,解析产生此现象的原因
(用离子方程式表示);
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是______________________________________________。
29.(10分)现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:
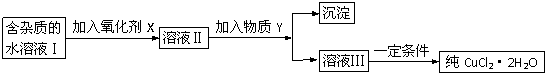
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,要将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。
请回答下列问题 [(1)~(2)小题填标号] :
(1)本实验最适合的氧化剂X是__________
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y不可以是___________
A.CuO B.CuCl2 C.Cu(OH)2 D.CuCO3
(3)若Y为Cu(OH)2,写出除去Fe3+的离子方程式:
_________________________________________
(4)加入氧化剂的目的是_______________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(如能,此空不填)_______________________________。
28.(8分)在一恒容密闭容器中发生某化学反应2A(g)
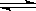 B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
 试回答下列问题:
试回答下列问题:
(1)在实验Ⅰ中,反应在20 min至40 min内A的平均反应速率为________mol·L-1min-1。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_____________________________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降 低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,则达到平衡时所需用的时间___________实验Ⅰ(填写“大于”、“等于”或“小于”)。
27.(8分)(1)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:N2(g) + 202(g)= 2N02(g) △H = +67.7 kJ/mol;
N2H4(g)+ 02(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4和NO2反应的热化学方程式为______________________________ _ 。
(2)取等体积、等物质的量浓度的盐酸和乙酸溶液分别与等量(足量)相同的锌反应,通过生成H2的快慢证明乙酸是弱酸。取用“相同”的锌的目的是___________ _________________________________________________________________,比较生成H2快慢的方法是_______________________________________________________。
26.(12分)下列反应在210℃达到平衡:
PCl5(g) PCl3(g)+Cl2(g) △H >0 K=1
①
PCl3(g)+Cl2(g) △H >0 K=1
①
CO(g)+Cl2(g) COCl2(g) △H <0 K=5×104
②
COCl2(g) △H <0 K=5×104
②
COCl2(g) CO(g)+
Cl2(g) △H >0
③
CO(g)+
Cl2(g) △H >0
③
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________
_______________________________,K值大小与温度的关系是:温度升高,K值___________________(填“一定增大、一定减小、或可能增大也可能减小”)。
(2)根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是
A.c(PCl5) = c(PCl3)= c(Cl2)=1
B.c(PCl5)= c(PCl3)·c(Cl2)=1
C.c(PCl5)= c(PCl3)·c(Cl2)
反应②和反应③的K值表达式 (填“相同”或“不同”)
(3)降低Cl2浓度,反应③的K值 ____ (填“增大”、“减少”或“不变”)
(4)要使反应①和反应②的K值相等,应采取的措施是
A.反应①、反应②同时升高温度
B.反应①、反应②同时降低温度
C.反应①降低温度,反应②维持210℃
25. 下面的各说法中正确的是
下面的各说法中正确的是
A.在100 0C时,纯水中的PH﹤7,呈中性
B.pH=5的稀醋酸,再加水冲稀100倍,溶液的pH=7
C.0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3 :1
D.在H2S溶液中C(H+) :C(S2-)=2 :1
B卷(综合应用 共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com