
题目列表(包括答案和解析)
15.在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) 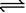
 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是(
)
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是(
)
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
14. 在一定温度下,向一容积不变的密闭容器中加入1 mol X气体和2mol Y气体,发生如下反应: X(g)
+ 2Y(g)  2Z(g)
, 此反应达到平衡的标志是 (
)
2Z(g)
, 此反应达到平衡的标志是 (
)
A.容器内压强不随时间变化
B.容器内气体密度不随时间变化
C. 容器内X、Y、Z的浓度之比为l : 2 : 2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
13.已知两个热化学方程式: C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是 ( )
A.1:1 B.1:2 C.2:3 D.3:2
12.下列过程中△H<0的是 ( )
A. 氯酸钾分解制氧气 B. 实验室用氯化铵和氢氧化钙制氨气
C.煅烧石灰石制生石灰 D.盐酸与NaOH溶液反应
11.有一支 酸式滴定管,其中盛有溶液,液面恰好在
酸式滴定管,其中盛有溶液,液面恰好在 刻度处。把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积( )
刻度处。把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积( )
A. 大于40.00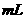 B. 为40.00
B. 为40.00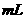 C. 小于
C. 小于 D. 为
D. 为
10.已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10 mol·L-1、Ka(HF)= 6.8×10-4 mol·L-1、Ka(CH3COOH)= 1.8×10-5 mol·L-1、、Ka(HNO2)= 6.4×10-6mol·L-1 物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是 ( )
A.HCN B.HF C.CH3COOH D.HNO2
9.4份各2g的NaOH固体,分别加入100mL下列各液体中,待一定时间后(不计水分挥发)溶液的导电能力变化不大的是 ( )
A.自来水 B.0.5mol/LHCl
C.0.5mol/LCH3COOH溶液 D.0.5mol/L氨水
8. 在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
( )
在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
( )
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
7.下列事实中,不能证明醋酸是弱酸的是 ( )
A.醋酸能使紫色石蕊试液变红 B. pH = 3的醋酸溶液稀释100倍后pH<5
C.醋酸钠溶液的pH>7 D.常温下,0.1 mol·L-1醋酸溶液pH=2.5
6.“熵”可看作是“混乱度”,它的符号是“S”。下列变化中,可以明显看出△S<0(“混乱度”减小)的是( )
A. 3Fe(s)+4H2O(g) = Fe3O4(s)+4H2(g) B.2NO2(g) = N2O4(l)
C.(NH4)2CO3(s) = 2NH3(g)+CO2(g)+2H2O(g) D.2IBr(l) = I2(s)+Br2(g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com