
题目列表(包括答案和解析)
25.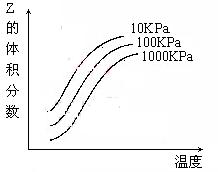 右图是温度和压强对X + Y
右图是温度和压强对X + Y  2Z
反应影响的示
2Z
反应影响的示
意图。图中横坐标表示温度,纵坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.上述反应的逆反应的△H<0
C.X和Y中只有一种是气态,Z为气态
D.X、Y、Z均为气态
24.下列说法或表示方法中,正确的是 ( )
A. 由C(石墨) → C(金刚石):△H = +119 kJ/mol可知,金刚石较石墨稳定
B.在稀溶液中,H+(ag) + OH一(ag) = H2O(1);△H= 一57.3KJ/mol。若将含0.5mol
H2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ
C.对于反应S ( s ) + O2 ( g ) = SO2 ( g ) △H = -297.23 kJ/mol,形成1 mol SO2( g ) 的化学键所释放的总能量小于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量
D.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
23.在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(气)+xB(气) 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是 ( )
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果不正确的是 ( )
A.平衡时,物质的量比A∶B∶C=2∶11∶4 B.x值等于4
C.平衡时,混合气体中B的体积分数为25% D. A的转化率20%
22.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是 ( )
A.向水中投入一小块金属钠 B.将水加热煮沸
C.向水中加入硝酸铵晶体 D.向水中加食盐晶体
21.下列关于电解质溶液的叙述中正确的是 ( )
A.Na2CO3、NaHCO3两种盐的溶液中,离子种类不相同
B.在CH3COONa溶液中c (CH3COO-) > c(Na+) > c(OH-) > c(H+)
C.在0.1mol·L-1的醋酸溶液中加入适量的蒸馏水,溶液的c(H+)/c(CH3COOH)增大
D.常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,则此溶液可能是盐酸
20.下列各组离子一定能在指定环境中大量共存的是 ( )
A.在c(H+)=10-10
mol/L的溶液中 Al3+
、NH 、Cl- 、NO
、Cl- 、NO
B.pH值为1的溶液 Fe3+、Na+ 、SO42-、HCO3-
C.水电离出来的c(H+)=10-12mol/L的溶液 K+、NH4+、Cl-、ClO-
D.pH值为13的溶液
K+ 、SO 、Na+、AlO2-
、Na+、AlO2-
19.某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0
2Z(g);ΔH<0

上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 ( )
A.t2时增大了压强 B.t3时降低了温度
C.t5时加入了催化剂 D.t6时反应物的转化率比t4时低
18.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
 HIn(溶液) H+(溶液)+ In-(溶液)
HIn(溶液) H+(溶液)+ In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液: ①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液
⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的是 ( )
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
17.在25℃进,浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2C2O4、(NH4)2Fe(SO4)2三种溶液中,测得其中c(NH4+)分别为a mol·L-1、b mol·L-1、c mol·L-1,则下列判断正确的是 ( )
A.a > b > c B.c > a > b C.b > a > c D.a > c > b
16.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是 ( )
2HBr(g)△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是 ( )
A.a>b B.a=b C.a<b D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com