
题目列表(包括答案和解析)
31. (18分)
(1) (12分)①(5分)HCl Fe3++3H2O 3Fe(OH)3 + 3H+
3Fe(OH)3 + 3H+
Al3++3HCO3-==Al(OH)3↓+3CO2↑
②(2分)<,< ③(5分)NH4+>SO42->H+>OH-,溶液中(NH4+)2 SO4=2NH4++SO42-,H2O H++OH-,NH4+和OH-结合生成弱电解质NH3.H2O,c(OH-)减小,促使水的电离平衡向右移动,使c(H+) >c(OH-),所以溶液呈酸性。
H++OH-,NH4+和OH-结合生成弱电解质NH3.H2O,c(OH-)减小,促使水的电离平衡向右移动,使c(H+) >c(OH-),所以溶液呈酸性。
(2)(6分) ①(2分)> ②(4分)0.05;10-10
32.(17分)
(1) (4分) 可逆反应的进行程度越大 可能增大也可能减小
(2) (5分) 0.03mol/(L.min) 2.25
(3) (8分) ①平衡 > ②d a
本资料由《七彩教育网》 提供!
30、(12分)
(1)(3分) A 水的电离是吸热过程 ,温度低时,电离程度小,c(H+)、c (OH-)小
(2)(4分)体积比为10 : 1 ; pH=7。
(3)(2分) pH = 11
(4)(3分)原因:曲线B对应95℃,此时水的离子积为10-12。pH=2的某HA溶液c(H+)=10-2mol/L,pH=10的NaOH溶液c (OH-)=10-2mol/L,等体积混合后,混合溶液的pH=5,呈酸性,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。
29、(12分)
(1)(7分)①放热;反应物的活化能;E1-E2。 ②减小 ③减小 减小 不移动
(2)(5分)H2(g)+1/2O2(g)== H2O(g) ;ΔH=–241.8 kJ·mol-1; –285.8
32.(17分)
(1) (4分)化学平衡常数K表示可逆反应的进行程度,K值越大,表示___________________________,K值大小与温度的关系是:温度升高,K值__________________________(填一定增大、一定减小、或可能增大也可能减小)。
(2)(5分)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应: CO(g)十H2O(g) 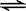 CO2(g)十H2 (g) △H<0
CO2(g)十H2 (g) △H<0
CO和H2O浓度变化如下图,则 0-4min的平均反应速率v(CO)=__________________,该温度下平衡常数K的数值为____________。

(3) (8分)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
① 表中3min-4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
② 反应在4min-5min间,平衡向逆方向移动,可能的原因是________(单选),
表中5min-6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
答案及说明
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
B |
D |
C |
C |
A |
B |
A |
D |
B |
B |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
A |
D |
A |
A |
B |
A |
B |
C |
D |
D |
|
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
|
|
|
C |
C |
C |
BD |
BC |
D |
AD |
C |
|
|
31.(18分)
(1)(5分)①在配制FeCl3 溶液时,常在溶液中加入一些_________________以抑制其水解;其水解反应的离子方程式为______________________________________________。
用Al2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式________________________________________________________。
② (2分)比较0.1mol/L的下列各种溶液的pH大小:
CH3COONa___________NaClO;CuSO4_________KHCO3。(填“>”、“<”或“=”)
③(5分)请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系_______________。请详细解释该溶液呈现酸性、碱性或中性的原因_________________________________ __________________________________________________________________________。
(2)(6分)25℃时,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。试回答以下问题:
①混合溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合物中下列算式的计算结果(填具体数字):c(A-)+c(HA)= mol/L; c(OH-)-c(HA)= mol/L。
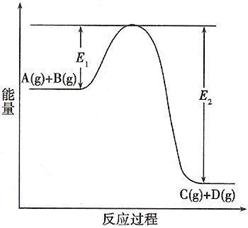
30.(12分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(1)(3分)则25 时水的电离平衡曲线应为 ________;
(填“A”或“B”),请说明理由 ________________
_________________________________________________;
(2)(4分)25时,将=9的NaOH溶液与=4的溶液混合,
若所得混合溶液的 =7,则NaOH溶液与溶液的体积比为 _____ ;
曲线B对应温度下,250mL 0.1mol/L的HCl溶液和250mL 0.3mol/L的NaOH溶液混合,求混合后溶液的pH =____ __;
(3)(2分)25时,将0.1mol/L的NaOH溶液逐滴滴入0.1mol/L的CH3COOH溶液中,当滴至溶液的c(Na+)=c(CH3COO-)时,溶液的pH_________7(填“>”、“<”或“=”)。
(4)(3分)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:______________________________________________ _____________________________________________________________________________________________________________________________________________________。
29.(12分)
(1)(7分)反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
C(g) +D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题。
① 图中E1代表的意义是______________________。该反应是_________反应(填“吸热”、“放热”)。反应热△H的表达式为__________________。
② 当反应达到平衡时,升高温度,A的转化率_________(填“增大”、“减小”或“不变”)。
③ 在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2_____(填“增大”、“减小”或“不变”)。化学平衡_________移动(填“向左”、“向右”或“不”)。
(2)(5分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式 ________________________________________________________________________
若1g水蒸气转化成液态水时放热2.444kJ,则H2的燃烧热△H=_____________ kJ· 。
。
28. 下列有关叙述正确的是 ( )
下列有关叙述正确的是 ( )
A.如右图所示,测定中和热时,大小两烧杯间填满碎纸的作用是固定小烧杯
B.若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.50mo1·L-1的硫酸充分反应,两反应测定的中和热不相等
C.在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液
D.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
27.将标况下1.12LCO2通入含有2gNaOH的水溶液中,完全反应并得到2L溶液,则对于该溶液表述正确的是 ( )
A.c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3)
B.c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-)
C.HCO3- 的电离程度大于HCO3-的水解程度
D.存在的平衡体系有:
HCO3-+
H2O  H2CO3+OH-, HCO3-
H2CO3+OH-, HCO3-  H+ + CO32-
,H2O
H+ + CO32-
,H2O  H++OH-
H++OH-
26.某温度下,在容积固定的密闭容器中发生可逆反应:A(气)+2B(气) 2C(气)。平衡时,各物质的浓度比为c (A) : c(B) : c(C)=1 : 1 : 2, 保持温度不变,以1 : 1 : 2的体积比再充入A、 B、C,则下列叙述正确的是 ( )
2C(气)。平衡时,各物质的浓度比为c (A) : c(B) : c(C)=1 : 1 : 2, 保持温度不变,以1 : 1 : 2的体积比再充入A、 B、C,则下列叙述正确的是 ( )
A.刚充入时反应速率v正减少,v逆增大
B.充入气体后平衡不发生移动
C.达到新的平衡时c (A) : c(B) : c(C)仍为1 : 1 : 2,
D.达到新平衡状态的过程中,体系压强先增大,后逐渐减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com