
题目列表(包括答案和解析)
2.下列分子式表示的物质一定是纯净物的是
A.C4H10 B.C3H6O C.CH4O D.C2H4Cl2
1.中学生经常使用的涂改液中含有挥发性的有毒溶剂,应告诫学生尽量不要使用,以减少对身体的毒害及环境的污染。该溶剂是
A.乙醇 B.乙酸 C.甘油 D.三氯乙烯
25.(12分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。
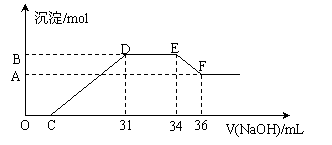
⑴图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____________________________________。上述现象说明溶液中______离子结合OH-的能力最弱。
⑶B与A的差值为________________________ mol。
⑷B对应的沉淀量为__________mol,C对应的溶液体积为____________mL。
2008-2009学年度第一学期期末六校联考
24.(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是
 H2A=H+ + HA-; HA- H+ +
A2-(注意:一级电离是完全电离)。回答下列问题:
H2A=H+ + HA-; HA- H+ +
A2-(注意:一级电离是完全电离)。回答下列问题:
⑴Na2A溶液显____________(填“酸性”、“中性”或“碱性”)。原因是_______________________________________(用离子方程式表示)。
⑵在0.1mol/L的Na2A溶液中,下列微粒浓度关系不正确的是_________。
A. c(A2- )+c(HA- )+c(H2A)=0.1mol/L B. c(H+ )=c(OH- )+c(HA- )
B. c(Na+ )+c(H+ )=c(OH- )+c(HA- )+2c(A2- ) C. c(Na+ )=2c(A2- )+2c(HA- )
⑶已知0.1mol/L NaHA溶液的pH=2,则0.1mol/L H2A溶液中氢离子的物质的量浓度____0.11mol/L(填“<”、“>”或“=”),理由是_____________________________________。
23.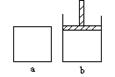
 (14分)已知2NO2 N2O4(放热),将NO2充入容易导热的
(14分)已知2NO2 N2O4(放热),将NO2充入容易导热的
材料制成的容器a和b中进行反应。a的容积保持不变,b的活
塞可随容器内气体压强的改变而上下自由移动,以保持容器内
压强相等。在同温同压时,将等量的NO2充入“起始态”体积
相同的容器a、b中反应。
⑴反应开始时,a和b中生成N2O4的速率v(a)______v(b),反应过程中生成N2O4的速率v(a)______v(b) (填“>”、“<”或“=”)。
⑵若在a中再充入与初始量等量的NO2,则达到平衡时NO2的转化率 _______;若在a、b中通入等量的氮气,则达到平衡时a中的NO2转化率将_______,b中的NO2转化率将______(填“增大”、“减小”或“不变”)。
⑶室温下若a、b都保持容器容积不变,a与外界不发生热量传递,b可以与外界进行热传递,则达平衡所需要的时间t(a)______t(b),平衡时容器______中的颜色较深。
⑷若在a容器中充入4.6g NO2,达到平衡后容器内混合气体的平均相对分子量为57.5,则NO2的转化率为____________。
22.(6分)将铁粉投入到盛有Cu2+、Ag+、Fe3+的溶液中,反应完毕时,若烧杯底部有铁粉剩余,则溶液中一定不含有的金属离子是_________________________;若烧杯中没有铁粉剩余,则溶液中一定含有的金属离子是_______________________;若溶液中不含Cu2+时,则一定不含有的其他金属离子是______________________________。
21.(10分)下图甲是课堂中验证铜和浓硝酸反应的演示实验装置,乙、丙是师生对该演示实验改进后的装置。
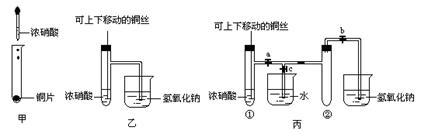
⑴甲、乙、丙三个装置中共同发生的化学反应方程式是
______________________________________________________________。
⑵和甲装置相比,乙装置的优点____________________________________。
⑶为了进一步验证NO2和水的反应,某学生设计了丙装置,先关闭弹簧夹_______,再打开弹簧夹_________,才能使NO2充满试管②。
⑷当气体充满试管②后,将铜丝提起与溶液脱离,欲使烧杯中的水进入试管②,应如何操作__________________________________________________。
⑸当试管②中的NO2和水充分反应后,所得溶液的物质的量浓度最大值是____________(气体按标准状况下计算)。
20.(8分)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行实验。
⑴该学生的操作是_______________的(填“正确的”或“错误的”),其理由是______________________________________________________________。
⑵若用此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是_____________,其原因是_________________________________________。
19. 一定温度下,将一定质量的纯醋酸加水稀释过程中,溶液的导电能力变化如图所示,有关说法不正确的是
一定温度下,将一定质量的纯醋酸加水稀释过程中,溶液的导电能力变化如图所示,有关说法不正确的是
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度: a<b<c
C.用湿润的pH试纸测量a处溶液pH,测定结果pH偏大
D.a,b,c三点处的溶液若分别用1mol/L NaOH溶液中和,消耗NaOH溶液的体积相等。
第Ⅱ卷(非选择题 共60分)
18.将体积都为10mL、pH都等于3的醋酸和盐酸,加水稀释至a mL和b mL,测得稀释后溶液的pH均为5,则稀释后溶液的体积:
A.a = b =100mL B.a = b =1000mL
C.a<b D.a>b
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com