
题目列表(包括答案和解析)
19.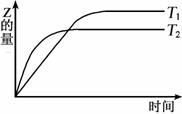 在密闭容器中进行如下反应:X2(g)+Y2(g)
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图示的正确判断是
2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图示的正确判断是
A.T1<T2,正反应是放热反应
B.T1<T2,正反应是吸热反应
C.T1>T2,正反应是放热反应
D.T1>T2,正反应是吸热反应
18. 在一定温度下,向V L体积固定的密闭容器中加入1 mol N2和3 mol H2,发生如下反应:N2+3H2 2NH3 。下列说法中可以充分说明该反应已经达到平衡状态的是
2NH3 。下列说法中可以充分说明该反应已经达到平衡状态的是
①容器内压强不随时间变化而变化 ②混合气体的密度不随时间变化而变化 ③NH3的浓度不再变化 ④N2、H2、NH3的浓度之比为1:3:2 ⑤N2、H2的转化率相等
A.①②③ B.②③⑤ C.①③ D.④⑤
17. 取浓度均为0.05 mol/L的硫酸和NaOH溶液,以2:3体积比相混合,所得溶液的pH为
A.2 B.3 C.11 D.12
16.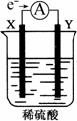 如右图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
如右图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
15. 下列说法正确的是
A.c(H+)= 的溶液一定呈中性
B.将水加热,KW增大,pH不变,仍呈中性
C.向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变
D.向0.1 mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+) 将减小
14. 下列实验操作和数据记录都正确的是
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,称得质量为10.2 g
B.用50 mL酸式滴定管量取KOH溶液,体积为36.60 mL
C.用湿润的pH试纸测稀盐酸溶液的pH,pH=3.52
D.用10 mL量筒粗略量取NaCl溶液,体积为9.2 mL
13. 某同学用铁片和稀硫酸在试管中制取氢气时,发现产生H2速率很慢,于是设想用下列措施来加快产生氢气的速率:①向试管内小心滴入0.5 mL浓硫酸并振荡,②向试管中加适量硫酸钠溶液,③向试管中滴入几滴硫酸铜溶液,④向试管中加入足量浓硝酸。其中能达到目的的是
A.①② B.①③ C.②④ D.③④
12. 对于常温下的盐酸与醋酸两种稀溶液,下列说法正确的是
A.相同物质的量浓度的两溶液中c(H+) 相同
B.分别加入水时,两溶液中各种离子浓度均减小
C.pH=3的两溶液均稀释100倍,盐酸的pH等于5,醋酸的pH小于5
D.等体积、等物质的量浓度的两溶液与NaOH完全中和时,醋酸消耗NaOH较多
11. 下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2SO2+O2 2SO3(正反应为放热反应)
2SO3(正反应为放热反应)
B.3O2 2O3(正反应为吸热反应)
2O3(正反应为吸热反应)
C.H2(g)+I2(g) 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
D.C(s)+CO2 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
10. 下列离子方程式书写正确的是
A.NaHS在溶液中水解 HS-+H2O H3O++S2-
H3O++S2-
B.向氯化铁溶液中加入铁 Fe3++Fe===2Fe2+
C.纯碱溶液呈碱性的原因
CO2-3 +2H2O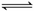 H2CO3+2OH-
H2CO3+2OH-
D.Fe(OH)3溶于氢碘酸 2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com