
题目列表(包括答案和解析)
7.下列物质属于强电解质的是
A.NaOH B.醋酸 C.SO2 D.H2O
6.在一定条件下,对于密闭容器中进行的可逆反应:N2 (g) + 3H2(g) 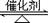 2NH3(g)
2NH3(g)
下列说法中,能充分说明这一反应已经达到化学平衡状态的是
A.N2.H2与NH3的物质的量之比为1︰3︰2
B.N2.H2与NH3的浓度相等
C.正.逆反应速率相等且不等于零
D.反应停止,正.逆反应速率都等于零
5.决定化学反应速率的主要因素是
A.反应物的浓度 B.反应温度
C.使用催化剂 D.反应物的性质
4.常温下,能溶于浓HNO3的单质是
A.Al B.Fe C.Cu D.Au
3.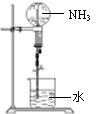 氨气可以做“喷泉实验”(装置如右图),这是利用氨气
氨气可以做“喷泉实验”(装置如右图),这是利用氨气
A.易液化 B.比空气轻
C.能与水反应 D.极易溶于水
2.2008年8月北京举办奥运会,北京市民为此作出的贡献之一是机动车实行单双号出行。这样做不仅可以保障交通畅通,而且能减少下列哪种气体排放造成的空气污染
A.SO2 B.N2 C.NO2 D.Cl2
1.为了科学地饮食,了解一些与食品相关的化学知识是必要的.油炸虾条.薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。 下列气体中最适宜充入的是
A.氮气 B.二氧化碳 C.空气 D.氧气
33.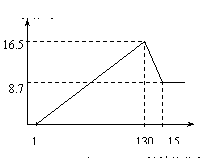 (9分)将一定量的铝镁合金投入到一定浓度的100 mL盐酸中,合金全部溶解。向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如下图所示。试计算:
(9分)将一定量的铝镁合金投入到一定浓度的100 mL盐酸中,合金全部溶解。向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如下图所示。试计算:
(1)原合金中Al、Mg的质量。
32.(4分) 5.76 g Cu与150 mL 2.0 mol/L稀硝酸充分反应。假设反应后的溶液仍为150 mL,求溶液中NO-3 的物质的量浓度(必须写出计算过程)。
31.(8分)某光卤石(KCl·MgCl2·6H2O)样品中含有不与盐酸和NaOH溶液反应的杂质。要测定其中镁元素的质量分数,可进行如下实验:
① 准确称取1.280 g样品,放入锥形瓶中加入适量的水溶解;
② 用滴定管向锥形瓶中加入0.5000 mol/L的NaOH溶液20.00 mL,振荡;
③ 向步骤②的锥形瓶中加入指示剂2-3滴;
④ 用0.1000 mol/L的盐酸滴定过量的NaOH至终点,消耗盐酸20.00 mL。
已知指示剂变色的pH范围分别是:石蕊5.0-8.0,酚酞8.2-10.0,甲基橙3.1-4.4。
回答下列问题:
(1)实验步骤②中发生反应的离子方程式是 。
(2)所有实验操作中,需要用待盛装的溶液润洗的仪器是_________________。
(3)为使测定结果误差小,应选用的指示剂是_________,理由是______________。
(4)如果在步骤④中滴加盐酸过量,则会使测定结果_______。(填“偏低”、“偏高”、“不受影响”)
(5)光卤石样品中镁元素的质量分数是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com