
题目列表(包括答案和解析)
3、X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池,X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断金属的活动性顺序是
A.Y>W>Z>X B. X>Z>W>Y C. Z>X>Y>W D.X>Y>Z>W
2、为了避免青铜器生成铜绿,以下方法不可取的是( )
A.将青铜器保存在潮湿的空气中 B.将青铜器保存在干燥的环境中
C.将青铜器放在铅质托盘上 D.在青铜器的表面覆盖一层防渗的高分子膜
1、天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:
CH4 + 2O2 CO2 + 2H2O,C3H8 + 5O2
CO2 + 2H2O,C3H8 + 5O2 3CO2 + 4H2O
3CO2 + 4H2O
现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是
A.增大空气进入量或减小石油气进入量 B.增大空气进入量或增大石油气进入量
C.减小空气进入量或减小石油气进入量 D.减小空气进入量或增大石油气进入量
33.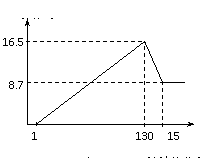 (9分)将一定量的铝镁合金投入到一定浓度的100 mL盐酸中,合金全部溶解。向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如下图所示。试计算:
(9分)将一定量的铝镁合金投入到一定浓度的100 mL盐酸中,合金全部溶解。向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积关系如下图所示。试计算:
(1)原合金中Al、Mg的质量。
32.(4分) 5.76 g Cu与150 mL 2.0 mol/L稀硝酸充分反应。假设反应后的溶液仍为150 mL,求溶液中NO-3 的物质的量浓度(必须写出计算过程)。
31.(8分)某光卤石(KCl·MgCl2·6H2O)样品中含有不与盐酸和NaOH溶液反应的杂质。要测定其中镁元素的质量分数,可进行如下实验:
① 准确称取1.280 g样品,放入锥形瓶中加入适量的水溶解;
② 用滴定管向锥形瓶中加入0.5000 mol/L的NaOH溶液20.00 mL,振荡;
③ 向步骤②的锥形瓶中加入指示剂2-3滴;
④ 用0.1000 mol/L的盐酸滴定过量的NaOH至终点,消耗盐酸20.00 mL。
已知指示剂变色的pH范围分别是:石蕊5.0-8.0,酚酞8.2-10.0,甲基橙3.1-4.4。
回答下列问题:
(1)实验步骤②中发生反应的离子方程式是 。
(2)所有实验操作中,需要用待盛装的溶液润洗的仪器是_________________。
(3)为使测定结果误差小,应选用的指示剂是_________,理由是______________。
(4)如果在步骤④中滴加盐酸过量,则会使测定结果_______。(填“偏低”、“偏高”、“不受影响”)
(5)光卤石样品中镁元素的质量分数是_____________。
30.(7分)某溶液含有Na+、Al3+、Fe2+、Cl-、NO-3、HCO-3、I- 等离子中的若干种。依次进行下列实验,现象如下:
① 用pH试纸检验,溶液的pH<7;
② 取少量溶液滴加氯水,再加入CCl4振荡、静置,下层显紫红色,而后分液;
③ 向实验②分液后所得的水溶液中加入AgNO3与HNO3的混合溶液,有白色沉淀产生;
④ 另取少量原溶液加入过量NaOH溶液,产生白色沉淀并迅速变为灰绿色,最后变为红褐色,然后过滤;
⑤ 向实验④所得滤液中通入过量CO2气体,有白色沉淀产生。
请回答下列问题:
(1)原溶液中肯定存在的离子有_____________,肯定不存在的阴离子有____________。
(2)实验④中白色沉淀变为红褐色的化学反应方程式为___________________________。
(3)实验⑤中产生白色沉淀的离子方程式是_____________________________________。
29.(9分)无机物A-J能发生下图所示的转化,其中A、B、C、D、G含有同一种元素,H是目前世界上用量最大的金属,E是气态单质,F可作磁性材料,J为红棕色固体。
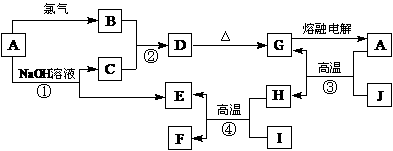
根据图示回答问题:
(1)写出下列物质的化学式:B________、G________、H________。
(2)反应③叫做________反应,该反应原理可用在生产上,如 。
(3)反应④的化学方程式为________________________________。
(4)写出下列反应的离子方程式:①_____________________,②__________________。
(5)在实验室把B完全转化为D,最好在B溶液中加入过量的___________。
28.(3分)航天技术使用的氢氧燃料电池具有高能、轻便、无污染等优点。氢氧燃料电池有酸式和碱式两种,酸式氢氧燃料电池中的电解质是酸,其负极的电极反应式为__________;碱式氢氧燃料电池中的电解质是碱,写出其电极反应式:负极__________________________;正极__________________________。
26.(4分)配平下列氧化还原反应方程式并回答问题:
Fe3O4+ HNO3 === Fe(NO3)3+ NO↑+ H2O
当溶解23.2 g Fe3O4时,转移电子________mol。
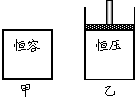 27.(6分)如右图,在一定温度下,向容积均为5 L的甲、乙两容器中分别充入0.5 mol N2O4气体,发生反应 N2O4
27.(6分)如右图,在一定温度下,向容积均为5 L的甲、乙两容器中分别充入0.5 mol N2O4气体,发生反应 N2O4 2NO2 。当反应进行到2 s时,测得甲容器中N2O4的浓度为0.08 mol/L。经过60 s时甲容器中的反应达到平衡。
2NO2 。当反应进行到2 s时,测得甲容器中N2O4的浓度为0.08 mol/L。经过60 s时甲容器中的反应达到平衡。
(反应过程中两个容器的温度均保持恒定)
(1)前2 s内,甲容器中以N2O4的浓度变化表示的平均反应速率为
。
(2)达到平衡时,乙容器中反应所需的时间 60 s(填“>”、“<”或“=”);两容器中的反应都达到平衡时, 容器中N2O4的转化率较大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com