
题目列表(包括答案和解析)
28.(3分)航天技术使用的氢氧燃料电池具有高能、轻便、无污染等优点。氢氧燃料电池有酸式和碱式两种,酸式氢氧燃料电池中的电解质是酸,其负极的电极反应式为__________;碱式氢氧燃料电池中的电解质是碱,写出其电极反应式:
负极__________________________;正极__________________________。
26.(4分)配平下列氧化还原反应方程式并回答问题:
Fe3O4+ HNO3 === Fe(NO3)3+ NO↑+ H2O
当溶解23.2 g Fe3O4时,转移电子数为______________。
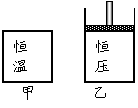 27.(6分)如右图,在一定温度下,向容积均为5 L的甲、乙两容器中分别充入0.5 mol N2O4气体,发生反应 N2O4
27.(6分)如右图,在一定温度下,向容积均为5 L的甲、乙两容器中分别充入0.5 mol N2O4气体,发生反应 N2O4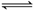 2NO2 。当反应进行到2 s时,测得甲容器中N2O4的浓度为0.08 mol/L。经过60 s时甲容器中的反应达容到平衡。
2NO2 。当反应进行到2 s时,测得甲容器中N2O4的浓度为0.08 mol/L。经过60 s时甲容器中的反应达容到平衡。 (反应过程中两个容器的温度均保持恒定)
(反应过程中两个容器的温度均保持恒定)
(1)前2 s内,甲容器中以N2O4的浓度变化表示的平均反应速率为
。
(2)达到平衡时,乙容器中反应所需的时间 60 s(填“>”、“<”或“=”);两容器中的反应都达到平衡时,
容器中N2O4的转化率较大。
25. 在含a mol Fe2(SO4)3和b mol CuSO4的混合溶液中,加入c mol Fe,充分反应后,经测定溶液中含有Fe2+ 和Cu2+,同时还有固体物质,则a、b、c的关系一定正确的是
A. a<c<(a+b) B. b<c<(a+b)
C. (a+c)<b
D. (a+b)<c
第Ⅱ卷(非选择题,共50分)
24.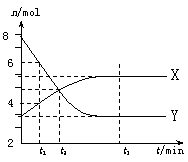 在一定温度下,某容器内气体X、Y的物质的量随反应时间变化的曲线如右图所示。下列判断错误的是
在一定温度下,某容器内气体X、Y的物质的量随反应时间变化的曲线如右图所示。下列判断错误的是
A. t1时,c(Y)=2c(X)
B. 反应的化学方程式为 2Y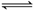 X
X
C. t2时,v(正)=v(逆),反应达到平衡状态
D. t3时,混合气体中X的体积分数为71.4 %
23. 下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A.AlCl3和NaOH B.NaHSO4和Ba(OH)2
C.Na2CO3和HCl D.NaAlO2和H2SO4
22. 常温下将稀NaOH溶液与CH3COOH溶液混合,不可能出现的结果是
A.pH<7且c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.pH>7且c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.pH>7且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D.pH=7且c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
21. 下列各组物质反应后,再滴入KSCN溶液不显红色的是
下列各组物质反应后,再滴入KSCN溶液不显红色的是
A.铁锈与稀硫酸 B.FeCl3和CuCl2的混合溶液与过量铁粉
C.过量FeO与稀硝酸 D.FeSO4酸性溶液与KNO3溶液
20. 甲、乙两个烧杯中分别盛有100 mL 4.0 mol/L的盐酸和NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为
A.1:1 B.2:3 C.3:2 D.3:1
19. 在密闭容器中进行如下反应:X2(g)+Y2(g)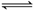 2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图示的正确判断是
2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图示的正确判断是
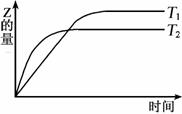 A.T1<T2,正反应是放热反应
A.T1<T2,正反应是放热反应
B.T1<T2,正反应是吸热反应
C.T1>T2,正反应是放热反应
D.T1>T2,正反应是吸热反应
18. 在一定温度下,向V L体积固定的密闭容器中加入1 mol N2和3 mol H2,发生如下反应:N2+3H2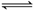 2NH3 。下列说法中可以充分说明该反应已经达到平衡状态的是
2NH3 。下列说法中可以充分说明该反应已经达到平衡状态的是
①容器内压强不随时间变化而变化 ②混合气体的密度不随时间变化而变化
③NH3的浓度不再变化 ④N2、H2、NH3的浓度之比为1:3:2
⑤N2、H2的转化率相等
A.①②③
B.②③⑤ C.①③
D.④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com