
题目列表(包括答案和解析)
12.下列方法中可以说明2HI(g)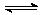 H2(g)+I2(g)已达到平衡的是( )
H2(g)+I2(g)已达到平衡的是( )
A.c(HI):c(H2):c(I2)=2:1:1时
B.温度和体积一定时,容器内压强不再变化
C.单位时间内生成n mol H2的同时生成2n mol HI
D.温度和压强一定时,混合气体的密度不再变化
11.如右图所示,A、B为石墨电极,烧杯中的电解质溶液只含一种溶质。接通直流电源后,观察到A电极有黄绿色气体产生, B电极有无色气体生成。下列判断正确的是 ( )
 A.电解一段时间后溶液的pH会增大
A.电解一段时间后溶液的pH会增大
B.A电极是阴极,通电后阴离子往A极移动
 C.向溶液中滴加无色酚酞试液,A电极附近先出现红色
C.向溶液中滴加无色酚酞试液,A电极附近先出现红色
D.总反应的离子方程式为:2Cl-+2H+ ===== H2↑+Cl2↑
10.电解原理在化学工业中有广泛的应用。下列说法正确的是 ( )
A.电解时,阴极发生氧化反应
B.若用电解方法精炼粗铜,粗铜作阴极,电解液可选用CuSO4溶液,
C.若要在铜片上镀银时,应将铜片接在电源的正极,将银片接在电源的负极
D.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀
9.下列说法或表示方法正确的是 ( )
A.需要加热才能发生的反应是吸热反应
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨)→C(金刚石);△H = +73 kJ/mol,可知金刚石比石墨稳定
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = +285.8kJ/mol
8.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中错误的是 ( )
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
7. 有关右图装置的叙述错误的是 ( )
A.这是一个将化学能转化为电能的装置
B.外电路中,电子由Fe通过导线流向Pt
C.该装置中Fe为负极,电极反应为:Fe-3e-=Fe3+
D.该装置中Pt为正极,电极反应为:
O2 + 2H2O + 4e-=4OH-
6.改变下列条件会使水的电离平衡向左移动(即抑制水的电离)的是( )
A.向水中加入氯化钠固体 B. 向纯水中加入盐酸
 C. 向纯水中加入醋酸钠固体
D. 升高温度
C. 向纯水中加入醋酸钠固体
D. 升高温度
5.水的电离过程为H2O H++OH-,在不同温度下水的离子积常数为:K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是 ( )
H++OH-,在不同温度下水的离子积常数为:K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是 ( )
A.纯水中c(H+)随着温度的升高而降低 B.在35℃时,纯水中c(H+)>c(OH-)
C.水的电离程度(25℃)>(35℃) D.水的电离是吸热的
4.用pH试纸测定溶液pH的正确操作是 ( )
A.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小条先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
3.反应A(g)+3B(g)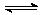 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
( )
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
( )
A.υ(C)=0.5 mol·L-1·s-1 B.υ(D)=0.4 mol·L-1·s-1
C.υ(B)=0.6 mol·L-1·s-1 D.υ(A)=0.15 mol·L-1·s-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com